
1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况)。向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2?1
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
C
【解析】本题考查有关合金的化学计算,意在考查考生的化学计算能力。设合金中Cu、Mg的物质的量分别为x、y,根据题目所给信息知x×64 g/mol+y×24 g/mol=1.52 g ①;设金属为M,在反应过程中有:M-ne-===Mn+,Mn++OH-===M(OH)n↓,从而可以看出,金属单质失去电子的物质的量等于金属阳离子完全沉淀所需OH-的物质的量,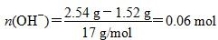 ,故2x+2y=0.06 mol ②,由①②解得x=0.02 mol,y=0.01 mol,显然A正确。
,故2x+2y=0.06 mol ②,由①②解得x=0.02 mol,y=0.01 mol,显然A正确。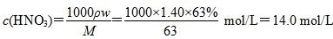 ,B正确。得到2.54 g沉淀时,消耗0.06 mol NaOH,其体积为60 mL,C错误。由上述分析可知,Cu、Mg共失去0.06 mol电子,根据得失电子守恒知,如果硝酸完全被还原为NO2,NO2的物质的量应为0.06 mol。现得到0.05 mol混合气体,是由于2NO2??N2O4,由差量法可求得N2O4为0.01 mol,则NO2为0.04 mol,显然D正确。
,B正确。得到2.54 g沉淀时,消耗0.06 mol NaOH,其体积为60 mL,C错误。由上述分析可知,Cu、Mg共失去0.06 mol电子,根据得失电子守恒知,如果硝酸完全被还原为NO2,NO2的物质的量应为0.06 mol。现得到0.05 mol混合气体,是由于2NO2??N2O4,由差量法可求得N2O4为0.01 mol,则NO2为0.04 mol,显然D正确。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源:2014高考名师推荐化学--预测17 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol·L-1 KNO3溶液:H+、Fe2+、SCN-、SO42-
B.c(H+)/c(OH-)=10-10的溶液:K+、Ba2+、 NO3-、Cl-
C.pH=0的溶液:Al3+、Ag(NH3)2+、Cl-、SO42-
D.c(ClO-)=1.0 mol·L-1的溶液:Na+、SO32-、S2-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测16 题型:实验题
课题式课堂教学是研究性学习的一种方式,其基本教学模式为:

如图甲是关于“一氧化碳的化学性质”的课题式课堂教学中解决问题阶段,甲同学设计的证明CO具有还原性的实验装置。
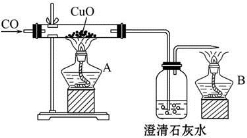
甲
(1)实验时应先点燃_____________(填“A”或“B”)处的酒精灯。
(2)硬质玻璃管中反应的化学方程式为__________________________________。
(3)乙同学认为甲装置有待优化,如尾气可先储存在瓶内,然后再处理。如图乙是他设计的贮气瓶,尾气应从__________(填“a”或“b”)口通入(其他装置略)。
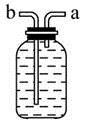
乙
(4)丙同学质疑:CO能否使澄清石灰水变浑浊?因此,他设计在CO通入CuO之前,应先通入澄清石灰水,以比较排除CO与澄清石灰水反应,试对此作出评价。你认为丙的设计是否有必要?____________,理由是________________。
(5)如果开始时通入的是CO和CO2的混合气体,则应如何设计才能达到实验目的?_________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测16 题型:选择题
某温度时,在密闭容器中X、Y、Z三种气体浓度的变化如图甲所示,若其他条件不变,当温度分别为T1和T2时,Y的体积分数与时间关系如图乙所示。则下列结论正确的是
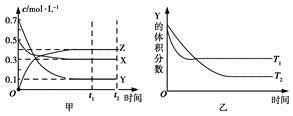
A.该反应的热化学方程式为X(g)+3Y(g)  2Z(g) ΔH>0
2Z(g) ΔH>0
B.若其他条件不变,升高温度,正、逆反应速率均增大,X的转化率减小
C.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动
D.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:填空题
2013年1月27日百度新闻资讯中报道,活性氧化锌是一种多功能性的新型无机材料,其颗粒大小约在1~100纳米。云南化工冶金研究所采用湿化学法(NPP-法)制备纳米级活性氧化锌,可用各种含锌物料为原料,采用酸浸出锌,经过多次净化除去原料中的杂质,然后沉淀获得碱式碳酸锌,最后焙解获得活性氧化锌,化学工艺流程如下:
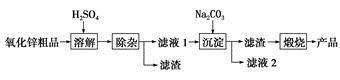
(1)通过________可以检验流程中滤液2中含有Na+。
(2)上述流程图中pH=12的Na2CO3溶液中c(CO32- )=0.50 mol/L,c( HCO3- )=1×10-2 mol/L,则c(Na+)∶c(OH-)=________。
(3)“溶解”后得到的酸性溶液中含有Zn2+、 SO42- ,另含有Fe2+、Cu2+等杂质。先加入________(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2。经检测溶液中Fe2+的浓度为0.009 mol·L-1,则每升溶液中至少应加入________mol KMnO4。
(4)已知常温下,Cu(OH)2的溶度积常数Ksp=2×10-20。溶液中杂质Cu2+浓度为0.002 mol·L-1,若要生成沉淀,则应调节溶液的pH大于________。
(5)“沉淀”得到ZnCO3·2Zn(OH)2·H2O,“煅烧”在450~500 ℃下进行,“煅烧”反应的化学方程式为:_____________________________________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:推断题
弹性涤纶是一种新型聚酯纤维,具有优异性能,能作为工程塑料、纺织纤维和地毯等材料而得到广泛应用。其合成路线可设计为:
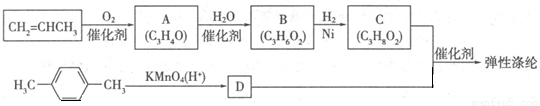
其中A、B、C均为链状化合物,A能发生银镜反应,C中不含甲基,1mol C可与足量钠反应生成22.4 L H2(标准状况)。请回答下列问题:
(1)A的结构简式为 ,B中所含官能团的名称为 。
(2)由物质C与D反应生成弹性涤纶的化学方程式为 。
(3)由物质B到C的化学反应类型为 。
(4)写出C与足量钠反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:选择题
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
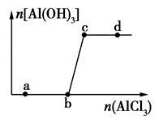
A.a点对应的溶液中:Na+、Fe3+、SO42- 、HCO3-
B.b点对应的溶液中:Ag+、Ca2+、NO3- 、F-
C.c点对应的溶液中:Na+、S2-、SO42- 、Cl-
D.d点对应的溶液中:K+、NH4+ 、I-、 CO32-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测13 题型:选择题
下列有关化学用语表示正确的是
A.乙醛的结构简式:CH3COH
B.H2O2的电子式:
C.次氯酸的电子式: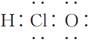
D.亚硫酸钠水解的离子方程式:SO32-+2H2O H2SO3+2OH-
H2SO3+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com