
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 ( 25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
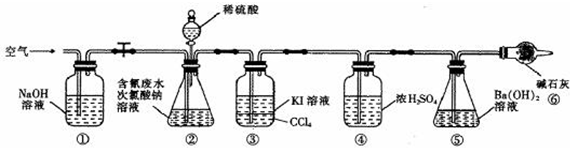
分析 探究一:测定含氰水样中处理百分率
处理含氰废水,并测定含氰废水的处理百分率实验的原理是:利用CN-+ClO-═CNO+Cl-;2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O,通过测定5的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率.根据装置中试剂的性质推测装置的位置;装置1吸收空气中二氧化碳,排除空气中的二氧化碳对实验的干扰,装置2产生二氧化碳,装置3的作用是吸收装置2中可能产生的Cl2,防止对装置5实验数据的测定产生干扰,装置4对产生的二氧化碳进行干燥,根据关系式计算含氰废水处理百分率,装置⑥的作用是排除空气中二氧化碳对实验的干扰,排除空气中二氧化碳对实验的干扰.
(1)实验的原理是利用CN-+ClO-═CNO+Cl-;2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O,通过测定碱石灰的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,实验中应排除空气中二氧化碳的干扰;
(2)反应结束后,缓缓通入空气,可将生成的二氧化碳全部被吸收;
(3)通过测定氢氧化钡溶液的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率;
探究二:探究氰化物的性质
(4)NaCN为强碱弱酸盐,水解呈碱性;
(5)弱酸的电离平衡常数越大,其酸性越强,等pH的弱酸溶液,酸性越强的酸其物质的量浓度越小,弱酸根离子水解程度越小,结合强酸能和弱酸盐反应制取弱酸分析;
(6)H2O2被称为“绿色氧化剂”,其还原产物为水由原子守恒分析A的化学式为KHCO3;
(7)处理含CN-废水时,用NaOH溶液调节至pH=9时(常温),Ki=5.0×10-10,Kh=1.6×109,c(OH-)=10-5,则$\frac{c(HCN)×10{\;}^{-5}}{c(CN{\;}^{-})}$=2×10-5;
解答 解:探究一:测定含氰水样中处理百分率
(1)实验的原理是利用CN-+ClO-═CNO+Cl-;2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O,通过测定碱石灰的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,实验中应排除空气中二氧化碳的干扰,防止对装置⑤实验数据的测定产生干扰,装置①和⑥的作用是排除空气中二氧化碳对实验的干扰,
故答案为:排除空气中二氧化碳对实验的干扰;
(2)反应后装置中残留二氧化碳,应继续通过将净化的空气,将装置内的残留的二氧化碳全部进入装置⑤,以减少实验误差,
故答案为:使生成的气体全部进入装置⑤;
(3)通过测定氢氧化钡溶液的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,则需要测定装置⑤反应前后的质量,
故答案为:⑤;
探究二:探究氰化物的性质
(4)NaCN为强碱弱酸盐,水解呈碱性,反应的离子方程式为:CN-+H2O?HCN+OH-,
故答案为:CN-+H2O?HCN+OH-;
(5)根据电离平衡常数知,酸性强弱顺序为:HCOOH>H2CO3>HCN>HCO3-,
A.氢氰酸的酸性大于碳酸氢根离子而小于碳酸,所以发生CN-+H2O+CO2→HCN+HCO3-反应,故A错误;
B.甲酸的酸性大于碳酸,所以2HCOOH+CO32-→2HCOO-+H2O+CO2↑能发生,故B正确;
C.等pH的HCOOH和HCN溶液,甲酸的物质的量浓度小于氢氰酸,所以中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者,故C正确;
D.根据电荷守恒,c(HCOO-)+c(OH-)=c(Na+)+c(H+),c(CN-)+c(OH-)=c(Na+)+c(H+),即离子总数是n(Na+ )+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中的c(OH-)大,c(H+)小,c(Na+)相同,所以甲酸钠中离子浓度大,故D错误;
故答案为:AD;
(6)H2O2被称为“绿色氧化剂”,其还原产物为水,H2O没有污染性,KCN+H2O2+H2O=A+NH3↑,由原子守恒可知A的化学式为KHCO3,
故答案为:KHCO3;
(7)处理含CN-废水时,用NaOH溶液调节至pH=9时(常温),CN-+H2O?HCN+OH-,Ka(HCN)=5.0×10-10,Kh=$\frac{c(OH{\;}^{-})c(HCN)}{c(CN{\;}^{-})}$×$\frac{c(H{\;}^{+})}{c(H{\;}^{+})}$=$\frac{Kw}{Ka}$=$\frac{10{\;}^{-14}}{5×10{\;}^{-10}}$=2×10-5,c(OH-)=10-5,则$\frac{c(HCN)×10{\;}^{-5}}{c(CN{\;}^{-})}$=2×10-5,则c(CN-)<c(HCN);
故答案为:<.
点评 本题综合考查物质含量的测定的实验设计、弱电解质的电离,以氯气的性质为载体考查化学实验设计和评价问题,注意把握实验原理和实验方法,(5)注意根据平衡常数确定酸性强弱,从而确定酸之间的转化,结合电荷守恒来分析,题目难度中等.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 平衡混合气的平均相对分子质量 | |
| B. | 平衡混合气中一种反应物的浓度 | |
| C. | 平衡混合气中一种生成物的体积分数 | |
| D. | 平衡混合气中一种反应物的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液中含有少量Na2CO3,可以用澄清石灰水除去 | |
| B. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 | |
| C. | 加水稀释CH3COONa溶液,溶液中的所有离子浓度都减小 | |
| D. | 金属铝的生产是以Al2O3为原料,在熔融状态下进行电解 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=7 | B. | pH≥7 | C. | pH≤7 | D. | C(H+)•C(OH-)=10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Mg2+)>c(Mn2+) | |
| B. | c(Mg2+)=c(Mn2+) | |
| C. | c(Mg2+)<c(Mn2+) | |
| D. | 沉淀类型不同,无法用Ksp比较二种离子的浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com