
【题目】SO2可用作红酒的防腐剂,下列关于SO2的叙述不正确的是
A.能使酸性KMnO4溶液褪色B.能使品红溶液褪色
C.能与NaOH溶液反应D.能与水反应生成硫酸
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于区域3的是

A. 4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
B. 2Na+Cl2![]() 2NaCl
2NaCl
C. Zn+CuSO4===ZnSO4+Cu
D. 2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是有机化工原料和优质燃料,主要应用于精细化工、塑料等领域,也是农药、医药的重要原料之一。
(1)已知反应CO(g)+2H2(g)== CH3OH(g) H= —99kJ.mol—1中的相关化学键键能如下:
化学键 | H-H | C-O | C≡O | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | x | 465 | 413 |
则x=___________________。
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g) ,
CH3OH(g) ,
CO在不同温度下的平衡转化率(α)与压强的关系如图所示。
①a、b两点的反应速率:v(b)____v(a)(填“>”、“<”或“=”)。②该反应的△S______0,图中的T1______T2(填“>”、“<”或“=”)。
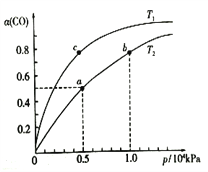
③该合成反应的温度一般控制在240~270℃,选择此温度范围的原因是:
I.此温度范围下的催化剂活性高;
II.______________________________________________________。
④图中a点的压强平衡常数KP=_______________(KPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)利用合成气(主要成分为CO和H2)合成甲醇,发生主要反应如下:
I:CO(g)+2H2(g)![]() CH3OH(g) H1
CH3OH(g) H1
II:CO2(g)+H2(g) ![]() CO(g) + H2O(g) H2
CO(g) + H2O(g) H2
III:CO2(g)+3H2(g)![]() CH3OH(g) + H2O(g) H3
CH3OH(g) + H2O(g) H3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化曲线如下图所示。
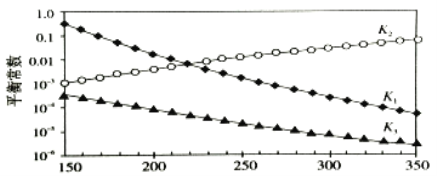
则H1___________H3(填“>”、“<”或“=”), 理由是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向100mL0.2mol/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液中NH4+和NH3·H2O的物质的量分数φ与加入盐酸的体积V及混合液pH变化的关系如图所示,下列说法正确的是

A. 表示NH3·H2O物质的量分数变化的曲线是B
B. pH=9.26时的溶液中,NH3·H2O的电离程度小于NH4+的水解程度
C. 常温下,NH3·H2O的电离常数为1.8×10-5mol/L(已知lg1.8=0.26)
D. 当加入盐酸体积为50mL时,溶液中c(NH4+)-c(NH3·H2O)=2×(10-5+10-9)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用水钴矿[主要成分为Co2O3和Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)提高水钴矿浸出速率的措施有_______________________________________(填写两点),浸出过程中Co2O3发生反应的离子方程式为________________________。
(2)NaClO3的作用是_________________________________。
(3)加Na2CO3调pH至5.2所得沉淀为_________________。
(4)萃取剂对金属离子的萃取率与pH的关系如图。萃取剂的作用是___________________________________________;其使用的适宜pH范围是______________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5

(5)由萃取后余液获得粗产品的操作步骤为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学常见的滴定法包括中和滴定法、氧化还原反应滴定法等。
(1)探究小组甲用酸性KMnO4溶液滴定某补血剂[主要成分硫酸亚铁晶体(FeSO47H2O)]中铁元素的含量。
①下列滴定装置中(夹持部分略去),最合理的是:__________(填字母序号)。
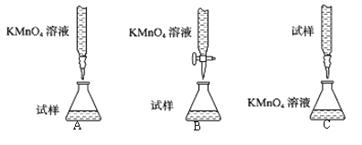
②该小组拟在同浓度的FeSO4溶液中,探究酸性KMnO4溶液浓度对Fe2+被氧化时反应速率的影响。限选试剂与仪器:0.10molL-1FeSO4、0.02molL-1酸性KMnO4、蒸馏水、锥形瓶、试管、胶头滴管、量筒、秒表。参照下表格式,完成实验表格(列出所选试剂体积和数据;数据用字母表示)。_____________、_____________、_____________、_____________。

(2)常温下,探究小组乙将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液的pH随加入盐酸体积的变化曲线如图所示。
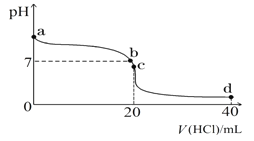
①a点处假设溶液的pH=10,则该点处由水电离产生的c(OH-)=__________________。
②取c点时的饱和溶液并向其加入水玻璃(硅酸钠水溶液),振荡、静置。写出实验现象并用必要的文字和相关离子方程式给予解释:___________________________________。
③d点所示溶液中离子浓度由大到小的排序是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明的溶液中:Fe3+、NH、I—、CO![]()
B. 0.1 mol·L-1 KNO3溶液中:Na+、Fe2+、Cl—、SO![]()
C. 使甲基橙变红的溶液中:Na+、Mg2+、SO![]() 、AlO
、AlO
D. 水电离产生的c(H+) =10-13mol·L-1的溶液中:K+、Ca2+、NO、HCO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯产量是衡量一个国家石油化工水平的主耍标志。下图是由乙烯合成乙酸乙酯可能的合成路线:
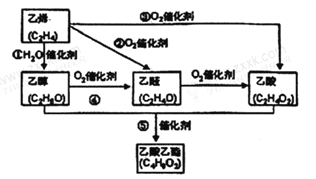
请回答下列问题:
(1)反应①的化学方程式为___________________。
(2)乙醇的同分异构体的结构简式为_____________;若实验证明乙醇分子有一个特殊氢原子的反应的化学方程式为____________________。
(3)若C4H8O2是一种由甲酸形成的酯,写出其中一种与氢氧化钠溶液反应的化学方程式为_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚酯纤维以其良好的抗皱性和保形性, 较高的强度与弹性恢复能力广泛应用在服装面料及毛绒玩具的填充物中。某种无毒聚酯纤维结构如下,下列说法不正确的是
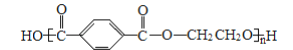
A. 聚酯纤维一定条件下可水解
B. 聚酯纤维和羊毛化学成分相同
C. 该聚酯纤维单体为对苯二甲酸和乙二醇
D. 由单体合成聚酯纤维的反应属于缩聚反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com