
| A、食醋用氢氧化钠溶液滴定,开始时溶液的pH通常变化缓慢,当接近滴定终点时,pH 出现突变,称为滴定突跃 |
| B、结晶时,若沉淀的结晶颗粒较大,静置后容易沉降到容器底部,此时,进行分离的操作方法是倾析 |
| C、抽滤装置由布氏漏斗、吸滤瓶、安全瓶、抽气泵等仪器组成,工作的主要原理是抽气泵给吸滤瓶减压,导致装置内部的压强降低,使过滤的速度加快 |
| D、在纸层析法分离Fe3+和Cu2+的实验中,层析后,经氨熏,滤纸中无色带出现,一定是误将试样点浸没在展开剂中 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
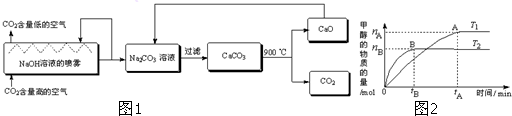
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
| B、0.1 mol H2O中含有电子的数目为NA |
| C、标准状况下,11.2L四氯化碳中含有分子的数目为0.5NA |
| D、0.5 mol?L-1 CaCl2溶液中的Cl-的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH、AlCl3 |
| B、CuSO4、BaCl2 |
| C、NaAlO2、HCl |
| D、MgCl2、AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用坩埚灼烧MgCl2?6H2O的反应式:MgCl2?6H2O
| ||||
| B、在0.1mol?L-1 Na2SO3溶液中:c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3) | ||||
| C、常温下,将PH=2的稀硫酸稀释10倍,其中各离子的浓度都变为原来的十分之一 | ||||
| D、蛋白质肽链中-NH-上的氢原子与羰基上的氧原子形成氢键是蛋白质二级结构的主要依据 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、①④ | C、②③ | D、③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com