
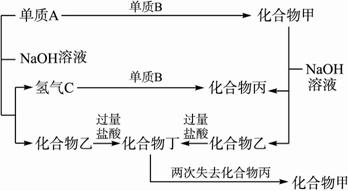
根据上述关系判断:?
(1)单质A只可能是 ,这是因为 。?
(2)单质B一定是金属还是非金属 ,这是因为 。?
(3)各化合物的分子式为:甲 、乙 、?丙 、?丁 。?
解析:本题是元素及化合物推断题,解题的突破口是短周期元素单质A与NaOH溶液反应生成氢气C,则单质A只可能是Al和Si,而产生的化合物乙与过量盐酸溶液反应生成的化合物丁能两次失去化合物丙生成化合物甲,则进一步推断出A单质不是金属Al,而只能是Si。又由于单质A和化合物甲都能跟NaOH溶液反应,都生成化合物乙(Na2SiO3),只不过A的另一种产物是氢气,而化合物甲的另一种产物为化合物丙,丙又可通过氢气与单质B反应生成,故单质B为O2,其他的各种化合物也就能推出来了。?
答案:(1)硅(Si) 在短周期内,能与NaOH溶液反应放出氢气的只可能是Al和Si,但Al的氢氧化物可溶于过量盐酸中,不符合题意,故A只能是Si?
(2)是非金属 Si只有和O2反应,才能生成酸性氧化物(SiO2)与碱液(NaOH溶液)反应(3)SiO2 Na2SiO3 H2O H4SiO4?


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:阅读理解

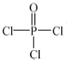 )与季戊四醇(
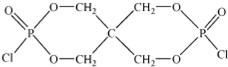
)与季戊四醇(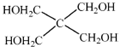 )以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体.季戊四醇与X 的核磁共振氢谱如图所示.
)以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体.季戊四醇与X 的核磁共振氢谱如图所示.

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
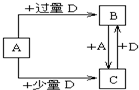 W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的一种原子的原子核中没有中子;Y与X相邻,Y与Z也相邻;X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高.试回答下列各题:
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的一种原子的原子核中没有中子;Y与X相邻,Y与Z也相邻;X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高.试回答下列各题:| 浓H2SO4 |
| △ |
| 浓H2SO4 |
| △ |
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 |
I | II | III | IV | V | VI | VII | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com