
高锰酸钾在不同的条件下发生的反应如下:
MnO4﹣+5e﹣+8H+═Mn2++4H2O①
MnO4﹣+3e﹣+2H2O═MnO2↓+4OH﹣②
MnO4﹣+e﹣═MnO42﹣(溶液绿色)③
(1)从上述三个半反应中可以看出高锰酸根离子被还原的产物受溶液的酸碱性影响.
(2)将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为 ﹣→ +.
(3)将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色.下列说法正确的
a.氧化性:PbO2>KMnO4
b.还原性:PbO2>KMnO4
c.该反应可以用盐酸酸化
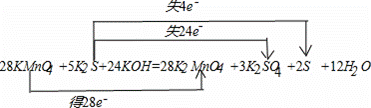
(4)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3:2,完成下列化学方程式(横线上填系数,括号内填物质):
KMnO4+ K2S+ KOH═ K2MnO4+3K2SO4+2S↓+ .
②若生成6.4g单质硫,反应过程中转移电子的物质的量为 .
考点: 氧化性、还原性强弱的比较;氧化还原反应的电子转移数目计算;氧化还原反应方程式的配平.
专题: 氧化还原反应专题.
分析: (1)根据离子颜色结合溶液酸碱性判断;
(2)得电子化合价降低的微粒发生还原反应;
(3)同一化学反应中氧化剂的氧化性大于还原产物的氧化性;
(4)根据氧化还原反应中得失电子数相等配平方程式,并注意也要遵循原子守恒;根据硫单质和转移电子之间的关系式计算转移电子数.
解答: 解:(1)根据反应式知,溶液的酸碱性不同溶液的颜色不同,所以溶液的颜色受溶液酸碱性的影响,故答案为:酸碱性;
(2)二氧化硫含有还原性,酸性条件下,高锰酸根离子得电子生成二价锰离子,所以高锰酸根离子有强氧化性,所以还原反应的过程为MnO4﹣→Mn2+,
故答案为:MnO4﹣;Mn2+;
(3)同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性,将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色,说明PbO2氧化二价锰离子生成高锰酸根离子,所以PbO2作氧化剂,高锰酸根离子是氧化产物,所以PbO2的氧化性大于高锰酸根离子,故选a;
(4)该反应中,高锰酸钾是氧化剂,一个高锰酸钾化学式得5个电子,硫化钾是还原剂,K2SO4和S的物质的量之比为3:2,所以硫化钾生成硫酸钾和硫单质失去的电子数是28个电子,所以得失电子的最小公倍数是140,所以高锰酸钾的计量数是25,硫化钾的计量数是5,其它元素根据原子个数相等配平,所以方程式为:28KMnO4+5K2S+24KOH=28K2MnO4+3K2SO4+3S↓+12H2O;
设转移电子数是x.
28KMnO4+5K2S+24KOH=28K2MnO4+3K2SO4+2S↓+12H2O 转移电子
2mol 28NA
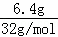 x=2.8NA,
x=2.8NA,
故答案为:28;5;24KOH;28;3;2;12H2O;2.8NA.
点评: 本题考查了有关物质的量的计算、氧化性和还原性的判断等知识点,难度不大,明确氧化性和还原性强弱的判断方法.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
据报道,摩托罗拉公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH 2K2CO3+6H2O请填空:
2K2CO3+6H2O请填空:
(1)充电时:①原电池的负极与电源负极相连.②阳极的电极反应式为 .
(2)放电时:负极的电极反应式为 .
(3)在此过程中若完全反应,乙池中A极的质量升高648g,则甲池中理论上消耗O2 L(标准状况下).
(4)若在常温常压下,1gCH3OH燃烧生成CO2和液态H2O时放热22.68kJ,表示该反应的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
36.5g HCl溶解在1L水中,所得溶液的密度为ρ g•mL﹣1,质量分数为w,物质的量浓度为cmol•L﹣1,NA表示阿伏加德罗常数,则下列叙述正确的是()
A. 所得溶液的物质的量浓度:c=1mol•L﹣1
B. 所得溶液中含有NA个HCl分子
C. 36.5g HCl气体在标准状况下占有的体积约为22.4L
D. 所得溶液的质量分数:w=36.5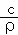
查看答案和解析>>
科目:高中化学 来源: 题型:
将51.2g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.9mol,这些气体恰好能被500ml 2mol/L NaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO3的物质的量为()
A. 0.2mol B. 0.4mol C. 0.8mol D. 0.9mol
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值,下列说法正确的是()
A. 7.8g Na2O2中离子总数为0.4NA
B. 标准状况下,11.2L CCl4中的分子数为0.5NA
C. 常温常压下,48g O2和O3的混合气体中含有的氧原子数为3NA
D. 2.7g金属铝变为铝离子时失去的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W四种短周期元素在周期表中相对位置如下表所示,Y是地壳中含量最高的元素.下列说法中不正确的是()
X Y
Z W
A. Z的原子半径大于Y
B. Y的非金属性强于W
C. W的氧化物对应的水化物都是强酸
D. X、Z的最高价氧化物均可与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
以下最接近阿伏伽德罗常数的是()
A. 2.0L 1.Omol•L﹣1 CH3COOH溶液中的H+离子数
B. 2.0L 1.0 mol•L﹣1CH3COONa溶液中的CH3COO﹣离子数
C. 1.0L 1.0 mol•L﹣1NaHCO3溶液中的HCO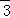 离子数
离子数
D. 1.0L 1.0 mol•L﹣1Na2CO3 溶液中的 C032﹣离子数
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 将10 g CaCO3粉末加入100 mL水中,所得溶液的浓度为l mol•L﹣1
B. 将100 mL 2 mol•L﹣1盐酸加热蒸发至50 mL,所得溶液的浓度为4 mol•L﹣1
C. 将l0 mL l.0mol•L﹣1NaCl溶液与90mL水混合,所得溶液的浓度为0.1 mol•L﹣1
D. 将10 g CaO加入100 mL饱和石灰水中,充分搅拌、静置并恢复到原来的温度,所得溶液的浓度不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com