
【题目】用KMnO4氧化盐酸溶液,反应方程式如2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,若产生的Cl2在标准状况下体积为56 L,计算:
(1)参加反应的HCl的物质的量________________
(2)反应中被氧化的HCl的物质的量__________________
(3)并用双线桥标出电子转移的方向和数目___________________________________
【答案】8 mol 5 mol 
【解析】
反应生成Cl2在标准状况下体积为56L,根据n=V/Vm计算物质的量,再根据方程式计算HCl,结合元素化合价的变化分析被氧化的HCl的量,双线桥标出电子转移的情况。
(1)56LCl2在标况下的物质的量为n=V/Vm=56/22.4=2.5mol,则参加反应的HCl的物质的量为2.5mol×16/5=8mol;
综上所述,本题答案是:8mol。
(2)反应中16molHCl只有10mol被氧化,即被氧化的HCl占总的HCl物质的量5/8,根据反应关系:10molHCl(被氧化)----5molCl2,现有2.5molCl2生成,所以反应中被氧化的HCl的物质的量为5mol;
综上所述,本题答案是:5mol。
(3)2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O+2KCl中,Mn元素的化合价降低,Cl元素的化合价升高,该反应转移10e﹣,电子的转移方向和数目为: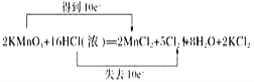 ;
;
综上所述,本题答案是: 。
。


科目:高中化学 来源: 题型:
【题目】比亚迪纯电动汽车采用一种具有高效率输出、可快速充电、对环境无污染等优点新型电池,其工作原理如图。M电极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,聚合物交换膜只允许Li+通过,而e-不能通过。电池反应式为LixC6+Li1-xFePO4![]() LiFePO4+6C。下列说法不正确的是
LiFePO4+6C。下列说法不正确的是

A. 放电时,N极是正极,电极反应式为Li(1-x)FePO4+xLi++xe-=LiFePO4
B. 充电时,Li+通过聚合物交换膜向M极迁移
C. 用该电池电解精炼铜,阴极质量增重19.2g时,通过聚合物交换膜的Li+数目为0.6NA
D. 充电时电路中通过0.5mol e-,消耗36gC
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是
A. 反应剧烈程度:两者相同
B. 消耗硝酸的物质的量:前者多,后者少
C. 反应生成气体的颜色:前者浅,后者深
D. 反应中转移的电子总数:前者多,后者少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为泡沫灭火器构造示意图,内筒a装有Al2(SO4)3溶液,外筒b装有饱和NaHCO3溶液。结合生活中的应用,下列分析错误的是

A. 使用时必须将泡沫灭火器倒立
B. 工作时HCO3-水解较彻底
C. 灭火时产生的Al(OH)3覆盖可燃物有利于阻隔氧气
D. 该灭火器可用于扑灭Na等金属着火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 反应2N2O(g)=2N2 (g)+O2(g)的△H<0,△S<0
B. 电解法精炼粗铜时,粗铜作阳极,纯铜作阴极
C. 反应KIO3+6HI=KI+3I2+3H2O,每消耗1molKIO3转移的电子数目为6×6.02×1023
D. 恒温恒容闭密容器中进行的反应C(s)+2NO(g)![]() N2(g)+CO2(g),当压强不再发生变化时,表明反应已达到平衡状态
N2(g)+CO2(g),当压强不再发生变化时,表明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,氯离子浓度最大的是
A. 200mL 1molL-1NaCl溶液 B. 50mL 1.5molL-1AlCl3溶液
C. 100mL 0.8molL-1MgCl2溶液 D. 200mL 2molL-1KCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上研究超导技术比较先进的国家,在高温超导材料中,铊(81Tl)是重要成分之,已知铊和铝是同主族元素,关于铊的性质推断错误的是
A.铊是银白色,质软的金属
B.铊不能形成稳定的气态氢化物
C.铊与浓硫酸反应生成T12(SO4)3
D.Tl(OH)3是两性氢氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 高级脂肪酸乙酯的碱性水解属于皂化反应
B. 蔗糖、淀粉、纤维素均为高分子化合物
C. 硫酸铜溶液可使蛋白质变性,可用于游泳池的杀菌消毒
D. 氨基酸分子中都含有-NO2 和-COOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com