
| A. | 直线形,三角锥形 | B. | V形,三角锥形 | ||
| C. | 直线形,正四面体形 | D. | V形,平面三角形 |
分析 价层电子对互斥理论认为:分子的立体构型是“价层电子对”相互排斥的结果.价层电子对就是指分子中的中心原子上的电子对,包括σ 键电子对和中心原子上的孤电子对,即分子中中心原子价层电子对个数=σ个数+孤电子对个数,由于价层电子对的相互排斥,就可得到含有孤电子对的VSEPR模型,略去孤电子对就是该分子的空间构型,如果价层电子对个数是4且不含孤电子对,则为正四面体结构,如果价层电子对个数是4且含有一个孤电子对,则为三角锥形结构,如果价电子对个数是4且含有2个孤电子对,则为V形,据此分析解答.
解答 解:H2O分子的中心原子O原子上含有2个σ 键,中心原子上的孤电子对数=$\frac{1}{2}$(a-xb)=$\frac{1}{2}$(6-2×1)=2,所以H2O分子的VSEPR模型是四面体型,略去孤电子对后,实际上其空间构型是V型;
BF3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电子对数=$\frac{1}{2}$(a-xb)=$\frac{1}{2}$(3-3×1)=0,所以BF3分子的VSEPR模型是平面三角型,中心原子上没有孤对电子,所以其空间构型就是平面三角形.
故选D.
点评 本题考查了分子空间构型的判断,难度不大,易错点是阴阳离子中孤电子对数的确定,注意中心原子上的孤电子对数=$\frac{1}{2}$(a-xb),a为中心原子的价电子数,x为与中心原子结合的原子数,b为与中心原子结合的原子最多能接受的电子数.


科目:高中化学 来源: 题型:填空题
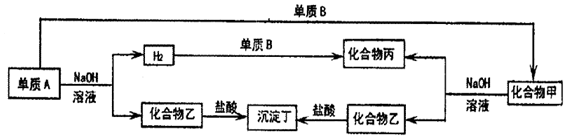
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属单质在化学反应中只能做还原剂 | |
| B. | 非金属单质在化学反应中只能做氧化剂 | |
| C. | 金属原子在化学反应中失去的电子越多,其还原性就越强 | |
| D. | 置换反应不一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
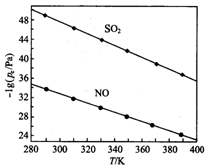 煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c/(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol•L-1Na2S溶液与0.1 mol•L-1NaHS溶液等体积混合:2c(H2S)═3c(Na+)-2c(HS-)-2c(S2-) | |
| B. | 0.1 mol•L-1氨水与0.05 mol•L-1盐酸等体积混合:c(OH-)+c (NH3•H2O)═c(Cl-)+c(H+) | |
| C. | pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合:c(CH3COOH)+c(H+)>c(OH-)+c(Na+) | |
| D. | 浓度均为0.1 mol•L-1的NH4HSO4溶液与NaOH溶液等体积混合:c(Na+)=c(SO${\;}_{4}^{2-}$)>c(NH${\;}_{4}^{+}$)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2在①、③反应中是氧化剂 | |
| B. | 氧化性强弱的顺序为:BrO3->ClO3->Cl2>Fe3+ | |
| C. | 溶液中可发生:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O | |
| D. | Cl2是ClO3- 的还原产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com