(2011?厦门一模)某化学兴趣小组用如图装置模拟工业制备造纸原料BaSO
3,并测定产品纯度.

(1)图1烧瓶中发生反应的化学方程式为
Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O
Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O
;
(2)甲同学观察到图1试管中出现白色沉淀,该白色沉淀可能含有①BaSO
3、②
BaSO4
BaSO4
;
实验一:探究白色沉淀的成分
(3)设计如下实验方案:
| 实验步骤 |
预期现象与结论 |
| 步骤1:用适量白色沉淀于试管中,加入少量蒸馏水,滴加几滴品红溶液 |
白色沉淀不溶解,溶液呈红色. |
| 步骤2:往上述试管中滴加足量 稀盐酸 稀盐酸 ,充分振荡. |
若 沉淀部分溶解 沉淀部分溶解 ,则含有②. |
实验二:测定产品纯度
(4)取白色沉淀wg于图2装置的试管,在分液漏斗中加入
稀硫酸
稀硫酸
(可从稀盐酸、稀硝酸、稀NaOH溶液中选择一种).实验后,测得C装置增重mg,根据此实验数据可计算出白色沉淀中BaSO
3的质量分数为
(用含m、w的式子表示).本测定方案有缺陷,请指出本方案的缺点及其对实验结果的可能影响.
答:
选用盐酸溶解沉淀,因为盐酸挥发出氯化氢气体被C吸收后可以导致结果偏大;二氧化硫未被完全吸收可能导致结果偏小
选用盐酸溶解沉淀,因为盐酸挥发出氯化氢气体被C吸收后可以导致结果偏大;二氧化硫未被完全吸收可能导致结果偏小
;
(5)为制备纯净的BaSO
3,请设计改进图1装置的实验方案.
答:
先从烧瓶的左边通入氮气排除这种中的空气
先从烧瓶的左边通入氮气排除这种中的空气
.




 寒假学与练系列答案
寒假学与练系列答案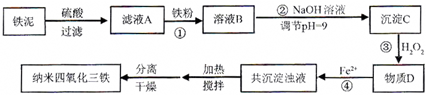
 (2011?厦门一模)常用于除去高速公路冰雪的是“氧盐类”融雪剂,如NaCl、MgCl2等.请回答
(2011?厦门一模)常用于除去高速公路冰雪的是“氧盐类”融雪剂,如NaCl、MgCl2等.请回答