

分析 (1)根据图1,可知,应该运用弱酸制强酸或较强酸制较弱酸的实验原理,即用硫酸制取二氧化碳,用二氧化碳与硅酸钠反应制硅酸来一次性完成C、Si三种非金属元素的非金属性强弱比较,根据强酸制弱酸来回答即可;B的作用是发生装置是硫酸和碳酸钠溶液发生反应,C中二氧化碳和硅酸钠反应;
(2)根据图2通过观察玻璃管中的实验现象,验证卤族元素性质的递变可知,运用非金属单质之间的置换反应来判断非金属元素的强弱,根据氧化性强的单质可以将氧化性弱的单质从其盐中置换出来结合反应产物来分析,烧瓶中的高锰酸钾溶液中滴入浓盐酸发生氧化还原反应生成氯气,氯气具有强氧化性,A、B两处分别是浸有NaBr溶液的棉花、湿润的淀粉KI试纸,氯气和溴化钠反应生成溴单质,和碘化钾反应生成碘单质.
解答 解:(1)①要比较碳和硅两种元素的非金属强弱,可以通过其最高价氧化物对应水合物的酸性强弱来判断,设计实验的依据是最高价氧化物水化物的酸性越强,对应元素的非金属性越强,
故答案为:最高价氧化物水化物的酸性越强,对应元素的非金属性越强;
②用较强酸制备较弱酸,因此可考虑把CO2气体通入Na2SiO3溶液,看是否有硅酸沉淀生成,比较特殊和硅酸的酸性强弱,B为溶液,则可判断B为Na2CO3,分液漏斗中是稀硫酸与B中碳酸钠反应制取CO2,判断硫酸和碳酸的酸性强弱,则A是稀硫酸,B是碳酸钠,C是硅酸钠溶液,
故答案为:稀硫酸;
③烧杯C中应是硅酸钠和二氧化碳反应,硅酸钠易溶于水可写成离子,CO2是气体,要保留分子式,因此烧杯中反应的离子方程式是:SiO32-+CO2+H2O═H2SiO3↓+CO32-(CO2不足),或是SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-(CO2过量),
故答案为:SiO32-+CO2+H2O═H2SiO3↓+CO32-(CO2不足)或SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-(CO2过量);
(2)由图2通过观察玻璃管中的实验现象,验证卤族元素性质的递变,所以验证卤族元素性质的递变规律的实验原理是:强氧化剂生成弱氧化剂或活泼的非金属单质置换出较不活泼的非金属单质,
①根据题意,浓盐酸与高锰酸钾反应会生成氯气,氯气经过浸有NaBr溶液的棉花,A处发生氧化还原反应:Cl2+Br-=Br2+2Cl-,
故答案为:Cl2+Br-=Br2+2Cl-;
②氯气经过B处会与KI反应生成I2,B处氯气与KI反应的化学方程式是:Cl2+2KI═2Cl-+I2,碘单质遇到淀粉变蓝色,
故答案为:试纸变蓝.
点评 本题将元素及其化合物、元素周期律与实验知识结合起来,考查了审题能力、思维能力,具有较强的综合性,题目难度中等.


 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 适当加热 | B. | 改用锌粉 | ||
| C. | 加入少量NaCl溶液 | D. | 加入少量1mol•L-1稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
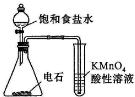
| A. | 用图装置检验乙炔的还原性 | |
| B. | 先加足量溴水,然后再加入酸性高锰酸钾溶液,鉴别己烯中是否混有少量甲苯 | |
| C. | 用裂化汽油从溴水中提取溴 | |
| D. | 将混合气体通过酸性高锰酸钾溶液,除去甲烷中混有的乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属 | B. | 周期表右上角非金属元素 | ||
| C. | 金属与非金属分界线附近的元素 | D. | 过渡元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极附近c(H+)逐渐增大 | |
| B. | SO42-向正极移动 | |
| C. | 正、负极附近c(H+)基本不变 | |
| D. | Fe片、Cu片同时冒出气泡,则说明Zn片不纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCH3COONa中含有的共用电子对总数为8NA | |
| B. | 标准状况下,将22.4LCl2溶于水,反应转移电子数为NA | |
| C. | 450℃时,在催化剂的作用下,将2molSO2与一定量的O2混合反应,一段时间后测得SO2消耗了$\frac{1}{2}$,则该正反应消耗了NA个SO2分子 | |
| D. | 78gNa2O2和Na2S的混合物中含有的阴离子数目一定是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
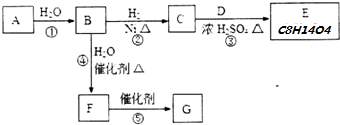
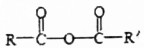 $\stackrel{H_{2}O}{→}$RCOOH+R′COOH(其中R,R′是烃基)
$\stackrel{H_{2}O}{→}$RCOOH+R′COOH(其中R,R′是烃基)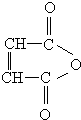 ,B中所含官能团的名称是羧基、碳碳双键;③和⑤的反应类型分别是取代反应、缩聚反应.
,B中所含官能团的名称是羧基、碳碳双键;③和⑤的反应类型分别是取代反应、缩聚反应.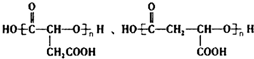 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
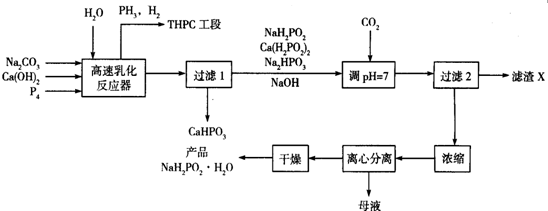
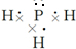 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=1的溶液中:K+、Na+、SO42-、HCO3- | |
| B. | 在0.1 mol•L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42- | |
| C. | 在0.1 mol•L-1 FeCl3溶液中:K+、NH4+、I-、SCN- | |
| D. | 在pH=12的溶液中:K+、Na+、ClO-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com