
 是环戊烯的结构简式,可进一步简写为
是环戊烯的结构简式,可进一步简写为 ,环戊烯的化学性质跟链烯烃相似.
,环戊烯的化学性质跟链烯烃相似.
 )臭氧化分解各种产物的结构简式及其物质的量之比n(HCHO):n(CH3COCHO)=2:1.
)臭氧化分解各种产物的结构简式及其物质的量之比n(HCHO):n(CH3COCHO)=2:1.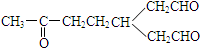 ,A经催化加氢得产物B,B的分子式是C10H20.分析数据表明,分子B内含有六元碳环.则A的键线式为
,A经催化加氢得产物B,B的分子式是C10H20.分析数据表明,分子B内含有六元碳环.则A的键线式为 .
. 分析 (1)根据题意,断裂位置为C=C,可生成HCHO、CH3COCHO;
(2)A经催化加氢得产物B,B的分子式是C10H20,且B内含有六元碳环,说明A中含有2个C=C,结合产物可知A、B的结构简式.
解答 解:(1)由题意可知,断裂位置为C=C,可生成HCHO、CH3COCHO,n(HCHO):n(CH3COCHO)=2:1,
故答案为:n(HCHO):n(CH3COCHO)=2:1;
(2)A经催化加氢得产物B,B的分子式是C10H20,且B内含有六元碳环,说明A中含有2个C=C,则A为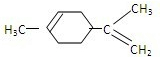 ,B为
,B为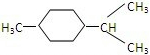 ,
,
故答案为: .
.
点评 本题考查有机物的推断,题目难度中等,解答本题的关键是把我题给信息,答题时注意体会.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题

| 三氯甲基苯基甲醇 | 式量:224.5.无色液体.不溶于水,溶于乙醇. |
| 醋酸酐 | 无色液体.溶于水形成乙酸,溶于乙醇. |
| 结晶玫瑰 | 式量:267.5.白色至微黄色晶体.熔点:88℃.不溶于水,溶于乙醇,70℃时在乙醇中溶解度为a g. |
| 醋酸 | 无色的吸湿性液体,易溶于水、乙醇. |
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将粗产品溶解在乙醇中,按粗产品、溶剂的质量比为1:$\frac{a}{100}$混合,用水浴加热到70℃回流溶剂使粗产品充分溶解 | 得到无色溶液 | 70℃时结晶玫瑰在乙醇中溶解 |
| ② | 将步骤1所得溶液冷却结晶 抽滤 | 得到白色晶体 | 在常温下结晶玫瑰在乙醇中溶解度较小 |
| ③ | 干燥步骤2所得白色晶体,加热使其融化,测其熔点 | 白色晶体在88℃左右完全熔化 | 白色晶体是结晶玫瑰 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为p轨道是“8”字形的,所以p的电子走“8”字形 | |
| B. | K能级有3s,3p,3d,3f四个轨道 | |
| C. | 氢原子只有一个电子,故氢原子只有一个轨道 | |
| D. | 以上说法均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mo1•L-1 | |
| B. | 标准状况下,22.4L水所含的分子数为NA | |
| C. | 常温常压下NO2和N2O4混合气体22.4L,其中含有的原子总数为0.3NA | |
| D. | 常温下,4gCH4含有NA个C-H共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素最高价氧化物的水化物肯定是一种强酸 | |
| B. | 该元素单质肯定是一种黄绿色的气体 | |
| C. | 该元素的最高价氧化物水化物肯定能与强碱反应 | |
| D. | 该元素的原子半径在同周期中肯定是最小的(稀有气体元素除外) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大容器的容积 | B. | 再充入一定量的N2O4 | ||
| C. | 分离出一定量的NO2 | D. | 再充入一定量的He |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;该微粒还可与Cu2+形成[Cu(H2O)4]+(填化学式)而使CuCl2溶液呈蓝色;
;该微粒还可与Cu2+形成[Cu(H2O)4]+(填化学式)而使CuCl2溶液呈蓝色;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 0.3 mol/L的HCl和50 mL 0.3 mol/L的NaOH相混合 | |
| B. | 80mL 0.3 mol/L的HCl和80 mL 0.3 mol/L的NaOH溶液相混合 | |
| C. | 80mL 0.3 mol/L的H2SO4和80 mL 0.3 mol/L的NaOH溶液相混合 | |
| D. | 50mL 0.3 mol/L的H2SO4和50 mL 0.6 mol/L的NaOH溶液相混合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com