
| A�� | ���ʷ�����ѧ��Ӧ�������������ı仯�����������仯�����ʱ仯���ǻ�ѧ�仯 | |
| B�� | 101kPaʱ��2H2��g��+O2��g���T2H2O��l����H=-571.6kJ•mol-1��H2��g����ȼ����Ϊ285.8kJ•mol-1 | |
| C�� | ����ͬ�����µ�ϡ��Һ�У�1molHCl��1molHNO3�ֱ�������NaOH��ַ�Ӧ���ų���������� | |
| D�� | H2+Cl2�T2HCl�������仯���������ͼ��ʾ |
���� A�������仯Ҳ�������������ı仯��
B������ȼ���ȵĶ����жϣ�
C.1molHCl��1molHNO3�ֱ�������NaOH��ַ�Ӧ���ų�������Ϊ�к��ȣ�
D��H2+Cl2�T2HClΪ���ȷ�Ӧ��
��� �⣺A����ѧ��Ӧ���ڹ��ۼ��Ķ��Ѻ��γɣ������������仯�������仯Ҳ�������������ı仯������̬��ΪҺ̬�ų���������A����
B��ȼ������1mol������ȫȼ�������ȶ���������ų���������101kPaʱ��2H2��g��+O2��g���T2H2O��l����H=-571.6kJ•mol-1����H2��g����ȼ����Ϊ285.8kJ•mol-1����B��ȷ��
C.1molHCl��1molHNO3�ֱ�������NaOH��ַ�Ӧ���ų�������Ϊ�к��ȣ����߷ų���������ͬ����C��ȷ��
D��H2+Cl2�T2HClΪ���ȷ�Ӧ����Ӧ������������������������������D��ȷ��
��ѡA��
���� �����ۺϿ��黯ѧ��Ӧ�������仯��Ϊ��Ƶ���㣬ע�����ȼ���ȡ��к��ȵĶ��壬���ⷴӦ���뻯ѧ��Ӧ�Ĺ�ϵ���ѶȲ���


 ������ѧ���̲���ȫ���ϵ�д�
������ѧ���̲���ȫ���ϵ�д� ������ʱ����ҵ����ϵ�д�
������ʱ����ҵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ˮ��Ӧ��Na+2H2O=Na++2OH-+H2�� | |
| B�� | ̼������Һ�м������ʯ��ˮ��Ca��OH��2+CO32-=CaCO3��+2OH- | |
| C�� | ����������Һ��ͨ�����CO2��OH-+CO2=HCO3- | |
| D�� | FeCl3��Һ��Cu��Ӧ��Cu+Fe3+=Cu2++Fe2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
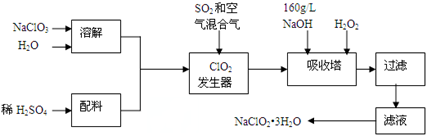
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
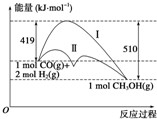 ���ú�̼������ϳ�ȼ���ǽ����ԴΣ������Ҫ��������֪CO��g��+2H2��g��?CH3OH��g����Ӧ�����е������仯�����ͼ��ʾ�����ߢ�����ߢ�ֱ��ʾ��ʹ�ô�����ʹ�ô�������������������ж���ȷ���ǣ�������
���ú�̼������ϳ�ȼ���ǽ����ԴΣ������Ҫ��������֪CO��g��+2H2��g��?CH3OH��g����Ӧ�����е������仯�����ͼ��ʾ�����ߢ�����ߢ�ֱ��ʾ��ʹ�ô�����ʹ�ô�������������������ж���ȷ���ǣ�������| A�� | �÷�Ӧ�ġ�H=+91 kJ•mol-1 | |
| B�� | ����������÷�Ӧ�ġ�H��С | |
| C�� | ��Ӧ���������С��������������� | |
| D�� | ����÷�Ӧ����Һ̬CH3OH�����H��С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ʱ���ܷ����Ĺ��̶��Ƿ��Է����� | |
| B�� | ��ϵ��������Խ�ߣ������Ҷ�Խ�ߣ���ֵ��Խ�� | |
| C�� | �����Է����еĻ�ѧ��Ӧ���Ƿ��ȷ�Ӧ | |
| D�� | ͬһ���ʵĹ̡�Һ��������״̬����ֵ��ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| Ӧ��ȡNaOH������/g | Ӧѡ������ƿ�Ĺ��/mL | ������ƿ���Ҫ�������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��֪2C��s��+O2��g��=2CO��g����H=-221 kJ•mol-1�����֪C�ı�ȼ����Ϊ110.5 kJ•mol-1 | |
| B�� | ��101KPa�������ı�ȼ���ȡ�H=-285.5 kJ•mol-1����ˮ�ֽ���Ȼ�ѧ����ʽ��2H2O��l��=2H2��g��+O2��g����H=+285.5 kJ•mol-1 | |
| C�� | ϡ������0.1 mol/LNaOH��Һ��Ӧ��H+��aq��+OH-��aq��=H2O��l����H=-57.3 kJ•mol-1 | |
| D�� | �ܱ������У�9.6 g�����11.2 g���ۻ�ϼ�������������17.6 gʱ���ų�19.12 kJ��������Fe��s��+S��g��=FeS��s����H=-95.6 kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ü���ʼ��鶹���Ķ�������� | |
| B�� | ����ķ�ɢ������ֱ��С��l00nm������1nm����ͨ����ֽ����������Ĥ | |
| C�� | ���������ƶ��������ǵ������Һ�����ԭ�� | |
| D�� | ����ȡ�ķ����������ͺ�ú�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ��һ�� | �ڶ��� | ������ | |
| �����mL�� | 16.10mL | 16.60mL | 15.90mL |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com