
【题目】甲、乙、丙三位同学分别用如下实验装置及化学药品(碱石灰为氢氧化钠和生石灰的混合物)制取氨气。请你参与探究,并回答问题:
(1)它们制取氨气的化学方程式为:______________________________________。
(2)三位同学都用向下排空气法收集氨气,其原因是_____________________。
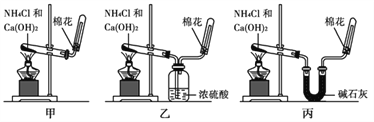
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨气(实验操作都正确),你认为没有收集到氨气的同学是________填(“甲”、“乙”或“丙”)。
(4)三位同学都认为他们的实验装置还可用于加热碳酸氢铵固体来制取纯净的氨气,你判断能够达到实验目的的是________填(“甲”、“乙”或“丙”),该装置中的NH4HCO3固体能否用NH4Cl固体代替?________(填“能”或“不能”)。
【答案】 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O NH3的密度小于空气的 乙 丙 不能
CaCl2+2NH3↑+2H2O NH3的密度小于空气的 乙 丙 不能
【解析】分析:(1)实验室用氢氧化钙和氯化铵在加热条件下制备氨气,据此书写方程式;
(2)根据氨气的溶解性和密度选择收集氨气的方法;
(3)根据氨气能与硫酸反应而被硫酸吸收分析;
(4)根据碳酸氢铵、氯化铵加热分解的生成物性质分析解答。
详解:(1)实验室用氢氧化钙和氯化铵在加热条件下制备氨气,反应的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(2)氨气极易溶于水,不能用排水法收集,氨气密度比空气小,应该用向下排空法收集;
(3)氨气为碱性气体,通过盛有浓硫酸的洗气瓶时,与硫酸反应而被吸收,所以乙同学不能得到氨气;
(4)碳酸氢铵加热分解生成氨气、二氧化碳和水,其中可用碱石灰吸收二氧化碳和水,只有丙能做到;氯化铵加热分解生成氨气和氯化氢,在温度较低时又重新化合反应生成氯化铵,因此只用氯化铵无法获得氨气。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案科目:高中化学 来源: 题型:
【题目】已知A是来自石油的重要有机化工原料,其产量用来衡量一个国家石油化工发展水平,E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。
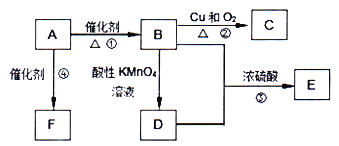
(1)A、D分子中的官能团分别名称为_______、_______。
(2)反应①的反应类型为________。
(3)反应②的化学方程式为_________。
(4)反应③的化学方程式为_______;该反应的反应类型为_____。
(5)反应④的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l) ![]() H=-632kJ·mol-1。右图为质子膜H2S燃料电池的示意图。下列说法不正确的是
H=-632kJ·mol-1。右图为质子膜H2S燃料电池的示意图。下列说法不正确的是
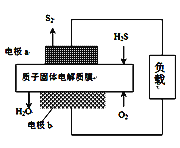
A. 电路中每流过2mol电子,电池内部释放316kJ热能
B. 每34gH2S参与反应,有2mol H+经质子膜进入正极区
C. 电极a为电池的负极
D. 电极b上发生的电极反应为:O2+4e![]() +4 H+=2H2O
+4 H+=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示.下列说法错误的是( ) 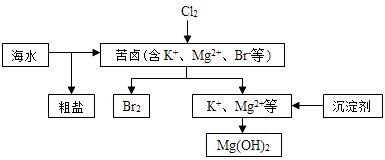
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
①NaAlO2(aq) ![]() Al(OH)3
Al(OH)3 ![]() Al2O3(熔融)
Al2O3(熔融) ![]() Al
Al ![]() Fe
Fe
②S ![]() SO3
SO3 ![]() H2SO4
H2SO4
③Cu(OH)2CO3 ![]() CuCl2(aq)
CuCl2(aq) ![]() Cu
Cu
④Fe2O3 ![]() FeCl3
FeCl3 ![]() 无水FeCl3
无水FeCl3
⑤饱和NaCl(aq) ![]() NaHCO3
NaHCO3 ![]() Na2CO3 .
Na2CO3 .
A.①③⑤
B.②③④
C.②④⑤
D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸H2B在水溶液中存在下列关系:①H2B=H++HB-,②HB-![]() H++B2-,则下列说法中一定正确的是
H++B2-,则下列说法中一定正确的是
A. 在Na2B溶液中一定有:c(OH![]() )=c(H
)=c(H![]() )+c(HB
)+c(HB![]() )+2c(H2B)
)+2c(H2B)
B. NaHB溶液可能存在以下关系:c(Na![]() )>c(HB
)>c(HB![]() )>c(OH
)>c(OH![]() )>c(H
)>c(H![]() )
)
C. NaHB水溶液中一定有:c(Na![]() )+c(H
)+c(H![]() )=c(HB
)=c(HB![]() )+c(OH
)+c(OH![]() )+c(B
)+c(B![]() )
)
D. NaHB溶液一定呈酸性,Na2B溶液一定呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42﹣可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( ) 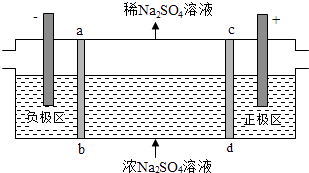
A.通电后中间隔室的SO42﹣离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O﹣4e﹣=O2+4H+ , 负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com