
| A. | 5.1g | B. | 10.2g | C. | 13.6g | D. | 15.3g |
分析 发生反应Mg+2HCl=MgCl2+H2↑,Fe+2HCl=FeCl2+H2↑,5.6L气体是氢气,氢气的物质的量为:$\frac{5.6L}{22.4L/mol}$=0.25mol,故参加反应的HCl的物质的量为0.25mol×2=0.5mol,溶液中n(HCl)=0.3L×2mol/L=0.6mol>0.5mol,故金属完全反应,反应后溶液中加入足量氨水,则镁离子、亚铁离子恰好完全转化为Mg(OH)2、Fe(OH)2,则m(沉淀)=m(金属)+m(OH-),由生成的氢气的物质的量,根据电子注意守恒计算n(OH-),再根据m=nM计算m(OH-),最后计算出沉淀的质量.
解答 解:镁、铁与盐酸反应的化学方程式为:Mg+2HCl=MgCl2+H2↑,Fe+2HCl=FeCl2+H2↑,
5.6L气体是氢气,氢气的物质的量为:氢气的物质的量为:$\frac{5.6L}{22.4L/mol}$=0.25mol,
故参加反应的HCl的物质的量为:0.25mol×2=0.5mol,溶液中n(HCl)=0.3L×2mol/L=0.6mol>0.5mol,则金属完全反应,
反应后溶液中加入足量氨水,则镁离子、亚铁离子恰好完全转化为Mg(OH)2、Fe(OH)2,
则m(沉淀)=m(金属)+m(OH-),
根据电子注意守恒可知:n(OH-)=2n(H2)=0.25mol×2=0.5mol,
所以生成沉淀的质量为:6.8g+0.5mol×17g/mol=13.6g,
故选D.
点评 本题考查化学方程式计算、混合物的有关计算,题目难度中等,注意从电子转移守恒计算n(OH-)是解答的关键,明确生成沉淀的质量=m(金属)+m(OH-),试题有利于提高学生的化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸滴入胆矾中,胆矾失水变白,发生了化学变化 | |
| B. | 二氧化硫能使溴水褪色,体现二氧化硫的漂白性 | |
| C. | 浓硫酸与灼热的木炭反应,体现浓硫酸的强氧化性和酸性 | |
| D. | 加热时硫与铜反应生成黑色的硫化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铁可用作红色油漆和涂料 | B. | 氧化铝可制耐高温实验材料 | ||
| C. | 明矾可用作净水剂 | D. | 用铝制餐具长时间存放碱性食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
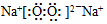 ,该化合物中的化学键类型有离子键、(非极性)共价键.
,该化合物中的化学键类型有离子键、(非极性)共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制氯气:MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| B. | 实验室制二氧化硫:Cu+SO42-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| C. | 实验室用浓氨水与生石灰制氨气:NH3•H2O+CaO═Ca(OH)2+NH3↑ | |
| D. | 实验室制二氧化氮:3Cu+4H++2NO3-═3Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH的电子式: | B. | 硫离子的结构示意图: | ||
| C. | 次氯酸钠分子式:NaClO | D. | Na2O2中过氧离子的化学式:O22- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com