
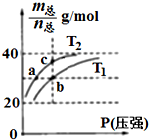
 已知(HF)2(g)?2HF(g),△H>0,且平衡体系的总质量[m(总)]与总物质的量[n(总)]之比在不同温度下随压强的变化曲线如图所示.下列说法正确的是( )
已知(HF)2(g)?2HF(g),△H>0,且平衡体系的总质量[m(总)]与总物质的量[n(总)]之比在不同温度下随压强的变化曲线如图所示.下列说法正确的是( )| A. | 温度:T1<T2 | |
| B. | 平衡常数:K(a)=K(b)<K(c) | |
| C. | 反应速率:Vb>Va | |
| D. | 当$\frac{m(总)}{n(总)}$=30g/mol时,n(HF):n(HF)2=2:1 |
分析 A、根据平衡体系的总质量[m(总)]与总物质的量[n总]之比为混合气体平均摩尔质量,反应是吸热反应,升温平衡正向进行,气体物质的量增大,总质量[m(总)]与总物质的量[n总]之比减小分析;
B、平衡常数随温度变化,不随压强变化;
C、依据温度对化学反应速率的影响判断;
D、根据$\frac{总质量}{总物质的量}$的值,可计算出混合体系中n(HF)与n(HF)2的比值并判断.
解答 解:A、根据平衡体系的总质量[m(总)]与总物质的量[n总]之比为混合气体平均摩尔质量,反应是吸热反应,升温平衡正向进行,气体物质的量增大,总质量[m(总)]与总物质的量[n总]之比减小分析,T1>T2,故A错误;
B、平衡常数随温度变化,不随压强变化,温度越高,平衡正向进行,平衡常数增大,平衡常数:K(a)=K(c)<K(b),故B错误;
C、分析判断可知T1>T2,温度越高反应速率越快,反应速率:Vb>Va,故C正确;
D、设n(HF):n[(HF)2]=x:y,根据$\frac{m{\;}_{(总)}}{n{\;}_{(总)}}$=$\frac{20x+40y}{x+y}$=30g/mol,得x:y=1:1,故D错误;
故选C.
点评 本题考查了化学平衡的建立过程分析,平衡影响因素的分析判断,掌握基础是关键,题目难度中等.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③⑤ | C. | ①③④⑤ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 辉石、斜长石及橄榄石均属于硅酸盐矿 | |
| B. | 斜长石的氧化物形式可表示为:K2O•Al2O3•6SiO2 | |
| C. | 橄榄石中铁为+2价 | |
| D. | 月球上有游离态铁是因为月球上铁的活性比地球上铁的活动性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 Al(OH)3 | 2.7 3.7 | 3.7 4.7 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 1866年凯库勒(如图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实( )
1866年凯库勒(如图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实( ) | A. | ①③⑤ | B. | ①②③④⑤ | C. | ①③④⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验.
合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳氧化物的转化有重大用途,回答关于CO和CO2的问题.
碳氧化物的转化有重大用途,回答关于CO和CO2的问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com