
 的分子式为C12H16O.
的分子式为C12H16O. 分子中,处于同一平面上的原子数最多可能有16个.
分子中,处于同一平面上的原子数最多可能有16个. 系统命名为4,4-二甲基-2-戊醇.
系统命名为4,4-二甲基-2-戊醇.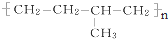 的单体为CH2=CH2、CH3-CH=CH2.
的单体为CH2=CH2、CH3-CH=CH2. 分析 (1)相同物质的量的①C2H4②C2H6O完全燃烧,其中C2H6O可以写成C2H4(H2O),所以耗氧的量与C2H4的耗氧的量相等;
(2)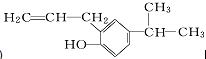 的分子式中有12个碳原子、一个氧原子,不饱和度为5,以此确定分子式;
的分子式中有12个碳原子、一个氧原子,不饱和度为5,以此确定分子式;
(3)当苯和双键所在的平面共平面时,处于同一平面上的原子数最多;
(4)-OH在2号位置,主链为5,有两个甲基;
(5)根据规律是“见双键,四个碳,无双键,两个碳”画线断开,然后将半键闭合,即将单双键互换,来分析解答.
解答 解:(1)相同物质的量的①C2H4②C2H6O完全燃烧,其中C2H6O可以写成C2H4(H2O),所以耗氧的量与C2H4的耗氧的量相等,故答案为:=;
(2) 的分子式中有12个碳原子、一个氧原子,不饱和度为5,所以氢原子数为12×2+2-5×2=16,所以分子式为C12H16O,
的分子式中有12个碳原子、一个氧原子,不饱和度为5,所以氢原子数为12×2+2-5×2=16,所以分子式为C12H16O,
故答案为:C12H16O;
(3)当苯和双键所在的平面共平面时,处于同一平面上的原子数最多,所以16个原子共平面,故答案为:16;
(4)-OH在2号位置,主链为5,有两个甲基,有机物名称为4,4-二甲基-2-戊醇,故答案为:4,4-二甲基-2-戊醇;
(5)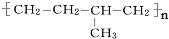 为加聚反应产物,将中括号去掉,按照“见双键,四个碳,无双键,两个碳”划线断开,然后将半键闭合可得该有机物的单体分别为:CH3-CH=CH2、CH2=CH2,
为加聚反应产物,将中括号去掉,按照“见双键,四个碳,无双键,两个碳”划线断开,然后将半键闭合可得该有机物的单体分别为:CH3-CH=CH2、CH2=CH2,
故答案为:CH2=CH2;CH3-CH=CH2.
点评 本题考查较为综合,涉及有机物燃烧的耗氧、求分子式、原子共平面的问题和加聚反应产物单体的书写,题目难度不大,注意掌握加聚反应原理,明确求算聚合反应产物单体的方法,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
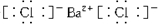 ,③的电子式是
,③的电子式是 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含共价键的共价化合物一定是分子晶体,分子晶体一定含共价键 | |
| B. | 固态可以导电的是离子晶体和金属晶体 | |
| C. | 由原子构成的晶体一定是原子晶体,由分子构成的晶体一定是分子晶体 | |
| D. | 判定晶体为离子晶体还是分子晶体的方法是看其熔融态是否能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | Q |
| A. | X、W分别与钠形成的化合物摩尔质量相同,且每种化合物中阴阳离子数比为1:2 | |
| B. | 含X和Z元素的常见化合物为离子化合物 | |
| C. | 氧化物对应的水化物酸性:W<Q | |
| D. | 原子半径大小关系:Q>W>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
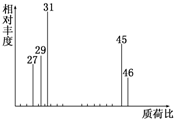 为了测定某有机物A的结构,做如下实验:
为了测定某有机物A的结构,做如下实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com