
【题目】苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
![]() +C2H5OH
+C2H5OH![]()
![]() +H2O
+H2O
已知:
颜色、状态 | 沸点(℃) | 密度(gcm﹣3) | |
苯甲酸* | 无色片状晶休 | 249 | 1.2659 |
苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
*苯甲酸在100℃会迅速升华.实验步骤如下:
①在圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、20mL环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按如图所示装好仪器,控制温度在6570℃加热回流2h.反应时环己烷一乙醇﹣水会形成“共沸物”(沸点62.6℃)蒸馏出来,再利用分水器不断分离除去反应生成的水,回流环己烷和乙醇.
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞.继续加热,至分水器中收集到的液体不再明显增加,停止加热.
③将烧瓶内反应液倒人盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性.
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层.加入氯化钙,对粗产物进行蒸馏(装置如图所示),低温蒸出乙醚后,继续升温,接收210213℃的馏分.
⑤检验合格,测得产品体积为13.16mL.
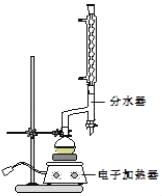
(1)在该实验中,圆底烧瓶的容积最适合的是_____(填入正确选项前的字母).
A.25mL B.50mL C.100mL D.250mL
(2)步骤①中沸石的作用是____,使用分水器不断分离除去水的目的是_____.
(3)骤②中应控制馏分的温度在__.
A.215220℃ B.8590℃ C.7880℃ D.6570℃
(4)步骤③加入Na2CO3的作用是________;若Na2CO3加入不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是________.
(5)关于步骤④中的萃取分液操作叙述正确的是____.
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗下口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算本实验的产率为____.
【答案】 C 防爆沸 使平衡不断地向正向移动 C 除去苯甲酸乙酯中的苯甲酸 在苯甲酸乙酯中有未除净的苯甲酸,受热至100℃时升华 AD 92.12%
【解析】(1)圆底烧瓶中液体的体积应该在容积1/3-2/3之间,在圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、20mL环己烷,以及4mL浓硫酸总体积在60ml左右,所以应该用100ml容量瓶,故选C。(2)反应过程需要加热,为了防止液体爆沸加一些沸石。分离器分离出生成的水,减少生成物从而使该反应向正反应方向移动,提高转化率。(3)温度低于苯甲酸乙酯的沸点时,苯甲酸乙酯不被蒸馏出,要使苯甲酸乙酯不被蒸馏出,则温度应低于苯甲酸乙酯的沸点,所以温度应低于![]() ,但要使乙醇和环己烷蒸馏出,所以温度应高于乙醇和环己烷的沸点80.8,因此应选C。(4)加入Na2CO3,Na2CO3能和苯甲酸反应,而和苯甲酸乙酯不反应,这样可以除去苯甲酸乙酯中的苯甲酸。若Na2CO3加入不足,则会有剩余的苯甲酸,苯甲酸在
,但要使乙醇和环己烷蒸馏出,所以温度应高于乙醇和环己烷的沸点80.8,因此应选C。(4)加入Na2CO3,Na2CO3能和苯甲酸反应,而和苯甲酸乙酯不反应,这样可以除去苯甲酸乙酯中的苯甲酸。若Na2CO3加入不足,则会有剩余的苯甲酸,苯甲酸在![]() 会迅速升华,苯甲酸固体小颗粒弥漫到空气中产生白烟。(5)分液漏斗的使用方法,是在水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,将分液漏斗倒转过来,用力振摇, A正确。振摇过程应该打开上口的玻璃塞放气,B错误。分液漏斗要放到铁架台上静置,C错误。放出液体时,需将玻璃塞上的凹槽对准漏斗口上的小孔,只有这样液体才能顺利流下, D正确。正确选项为AD。(6)假如苯甲酸完全反应,则生成苯甲酸乙酯的物质的量等于苯甲酸的物质的量为12.20/122=0.1mol。而实际生成的苯甲酸乙酯的物质的量为:13.16×1.05/150=0.09212mol,因此产率为0.09212mol/0.1mol=92.12%。
会迅速升华,苯甲酸固体小颗粒弥漫到空气中产生白烟。(5)分液漏斗的使用方法,是在水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,将分液漏斗倒转过来,用力振摇, A正确。振摇过程应该打开上口的玻璃塞放气,B错误。分液漏斗要放到铁架台上静置,C错误。放出液体时,需将玻璃塞上的凹槽对准漏斗口上的小孔,只有这样液体才能顺利流下, D正确。正确选项为AD。(6)假如苯甲酸完全反应,则生成苯甲酸乙酯的物质的量等于苯甲酸的物质的量为12.20/122=0.1mol。而实际生成的苯甲酸乙酯的物质的量为:13.16×1.05/150=0.09212mol,因此产率为0.09212mol/0.1mol=92.12%。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.反应热和焓变的单位都是 kJ
B.相同条件下,生成物的总能量大于反应物的总能量时,反应吸热,ΔH>0
C.在任何条件下,化学反应的焓变都等于化学反应的反应热
D.任何化学反应的反应热均可通过实验直接测定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应CH4(g)+H2O(g)CO(g)+3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压下,平衡时φ(CH4)的体积分数与Z和T(温度)的关系如图所示.下列说法正确的是( ) 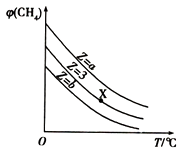
A.该反应的焓变△H<0
B.图中Z的大小为a<3<b
C.图中X点对应的平衡混合物中 ![]() =3
=3
D.温度不变时,图中X点对应的平衡在加压后φ(CH4)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于SO2性质的说法中,不正确的是
A. 能使品红溶液褪色 B. 能与水反应生成硫酸
C. 能与NaOH溶液反应 D. 能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要意义.
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等. 已知①Fe2O3(s)+3C(石墨,s)=2Fe(s)+3CO(g)△H1=+489.0kJmol﹣1
②C(石墨,s)+CO2(g)=2CO(g)△H2=+172.5kJmol﹣1
则CO气体还原Fe2O3(s)的热化学方程式为 .
(2)将CO2转化为甲醇的热化学方程式为CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0.850℃时, 该反应的平衡常数K=1.
①该反应的平衡常数表达式为 .
②若反应的容器容积为2.0L,反应进行4.0min时,容器内气体的物质的量减少了0,8mol,这段时间内υ(CO2)= .
③850℃时,若向1.0L的密闭容器中同时充入3.0molCO2(g)、1.0mol H2(g)、1.0mol CH3OH(g)和
5.0mol H2O(g),上述反应向(填“正反应”或“逆反应”)方向进行.
④若上述反应的平衡常数K值增大,该反应(填序号).
a.一定下正反应方向移动 b.一定下逆反应方向移动
c.在平衡移动过程中正反应速率先增大后减小 d.在平衡移动过程中逆反应速率先减小后增大.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
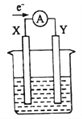
A. 外电路的电流方向为:X→外电路→Y
B. 若两电极分别为Zn和石墨棒,则X为石墨棒,Y为Zn
C. SO42-移向X电极,Y电极上有氢气产生
D. X极上发生的是还原反应,Y极上发生的是氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 某实验小组对H2O2的分解做了如下探究。下表是研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 mL5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
块状 | 微热 | 反应较慢,火星红亮,但木条未复燃 | 30 min |
(1)该反应是_________反应(填“放热”或“吸热”)。
(2)实验结果表明,催化剂的催化效果与_____________有关。
Ⅱ.某可逆反应在体积为5 L的密闭容器中进行,0~3分钟内各物质的物质的量变化情况如图所示(A、B、C均为气体)。
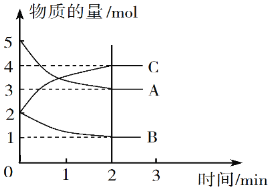
(3)该反应的化学方程式为_____________。
(4)反应开始至2分钟时,B的平均反应速率为__________。
(5)能说明该反应已达到平衡状态的是_________(填字母)。
A.v(A)= 2v(B) B.容器内压强保持不变
C.v逆(A)= v正(C) D.容器内混合气体的密度保持不变
Ⅲ.已知:断开1 mol共价键吸收的能量或形成1 mol共价键释放的能量数据如下表:
共价键 | H—H | N—H | N≡N |
能量变化/kJ·mol1 | 436 | 390.8 | 946 |
(6)已知合成氨反应:N2(g)+3H2(g)![]() 2NH3(g),则N2(g)与H2(g)反应有2 mol NH3(g)生成时,能量的变化情况是_________(填“吸收”或“放出”以及具体数值)kJ。
2NH3(g),则N2(g)与H2(g)反应有2 mol NH3(g)生成时,能量的变化情况是_________(填“吸收”或“放出”以及具体数值)kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源特点的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A. ①②③④ B. ⑤⑥⑦⑧ C. ①③⑥⑧ D. ②④⑥⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com