
【题目】下列化学用语对事实的表述不正确的是( )
A. 电解精炼铜的阴极反应:Cu2++2e-===Cu
B. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
C. 由Na和Cl形成离子键的过程:![]()
D. 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O![]() NH4++OH-
NH4++OH-
科目:高中化学 来源: 题型:
【题目】氮化锂(Li3N)常作固体电解质和催化剂,遇水蒸气剧烈反应生成氢氧化锂和氨气。某实验小组用一瓶氮气样品制备纯净的氮化锂的装置如图所示。

已知:连苯三酚碱性溶液能定量吸收少量O2,氯化亚铜盐酸溶液能定量吸收少量CO生成Cu(CO)Cl·H2O且易被O2氧化;在加热条件下,CO2与锂发生剧烈反应。下列说法正确的是
A. 干燥管e中试剂为无水CuSO4,用于检验氮气中的水蒸气
B. 为了减少气体用量,先点燃酒精灯再通入氮气
C. a、c中试剂分别为连苯三酚碱性溶液、浓硫酸
D. a装置可以换成盛装赤热铜粉的硬质玻璃管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3晶体,相应的实验流程如图所示。

请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X___,沉淀A____。
(2)上述实验流程中①②③步均要进行的实验操作是___(填操作名称)。
(3)上述实验流程中加入过量Na2CO3溶液的目的是______________________________。
(4)按此实验方案得到的溶液3中肯定含有______(填化学式)杂质。为了解决这个问题,可以向溶液3中加入适量的___(填化学式),之后若要获得NaNO3晶体,需进行的实验操作是____(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以A和B为原料合成扁桃酸衍生物F的路线如下:

(1)A的分子式为C2H2O3,可发生银镜反应,且具有酸性,A所含官能团的名称为_________。写出A+B![]() C的反应类型:_________。
C的反应类型:_________。
(2) 中①、②、③三个-OH与钠反应活性由强到弱的顺序是_____。
中①、②、③三个-OH与钠反应活性由强到弱的顺序是_____。
(3)E是由2分子C生成的含有3个六元环的化合物,E分子核磁共振氢谱峰面积之比_______。
(4)D![]() F的反应方程式是______________,1molF在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为____________mol,符合下列条件的F的所有同分异构体有四种(不考虑立体异构),写出其中两种的结构简式:___________。
F的反应方程式是______________,1molF在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为____________mol,符合下列条件的F的所有同分异构体有四种(不考虑立体异构),写出其中两种的结构简式:___________。
①属于一元酸类化合物 ②苯环上只有2个取代基且处于对位,其中一个是羟基
(5)已知: ,下列流程是A的一种合成方法___________,写出方框中各物质的结构简式:
,下列流程是A的一种合成方法___________,写出方框中各物质的结构简式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的数值。请回答下列问题:
(1)0.5mol SO2共含有约_______个原子,它与_______g SO3所含硫原子数相等。
(2)质量相同的①HCl、②NH3、③CO2、④O2四种气体中,在同温同压条件下,所占体积最小的是(填序号)___________。
(3)19g某二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的摩尔质量是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于0.10 mol·L-1 NaHCO3溶液的说法正确的是( )
A. 溶质的电离方程式为NaHCO3===Na++H++CO![]()
B. 25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
C. 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO![]() )+c(CO
)+c(CO![]() )
)
D. 温度升高,c(HCO![]() )增大
)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、X是中学化学中常见的四种物质,且a、b、c中含有同一种元素,其转化关系如下图所示。下列说法不正确的是
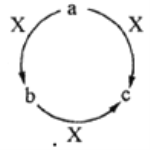
A. 若a、b、c均为厨房中常用的物质,则构成c中的阳离子半径小于其阴离子半径
B. 若a为一种气态氢化物,X为O2,则a分子中可能含有10个或者18个电子
C. 若b为一种两性氢氧化物,则X可能是强酸,也可能是强碱
D. 若a为固态非金属单质,X为O2,则O元素与a元素的原子序数之差可能为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联合国将2019年定为“国际化学元素周期表年”,2018年中国化学会制作了新版周期表,包含118种元素。回答下列问题:
J | B | ||||||||||||||||
M | x | ||||||||||||||||
A | |||||||||||||||||
(1)写出硅元素在周期表中的位置是______。
(2)化合物W是由AB两种元素构成的,用电子式表示其形成过程______________。
(3)用M单质作阳极,J单质作阴极,Ca(HCO3)2溶液作电解液,进行电解,阴极生成的气体和沉淀分别是______,阳极也生成气体和沉淀,写出阳极的电极反应式 ______ 。
(4)从原子结构角度解释碳化硅中碳元素显负价的原因______。
(5)第118号元素为Og(中文名“![]() ”,ào),下列说法正确的是______。
”,ào),下列说法正确的是______。
a.Og是第七周期0族元素 b.Og原子的核外有118个电子
c.Og在同周期元素中非金属性最强 d.中子数为179的Og核素符号是![]()
(6)已知X与Y是位于相邻周期的同主族元素。某温度下,X、Y的单质与H2化合生成气态氢化物的平衡常数分别为KX =9.7×1012、KY =5.6×107。Y是______(填元素符号),判断理由是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图像的叙述正确的是
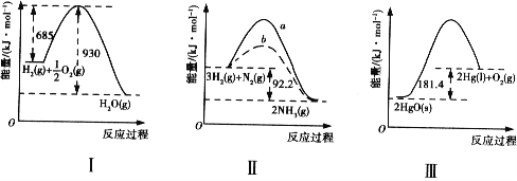
A. 图 I:H2 的燃烧热为 245 kJ/mol
B. 图 II:b 可能为使用催化剂的曲线,活化能降低
C. 图 II:向容器中充入 1 mol N2、3 mol H2,充分反应后放出热量 92.2 kJ
D. 图 III:HgO(s) = Hg(l) + 1/2O2(g) △H = - 90.7 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com