
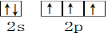 .
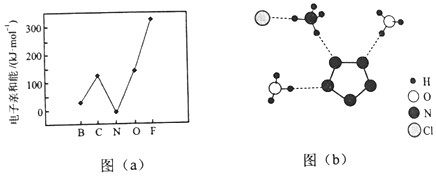
.
分析 (1)氮原子价层电子为最外层电子,即2s22p3,书写电子排布图;
(2)同周期从左到右核电荷数依次增大,半径逐渐减小,从左到右易结合电子,放出的能量增大,N的最外层为半充满结构,较为稳定;
(3)①根据图(b),阳离子为H3O+和NH4+,NH4+中心原子N含有4个σ键,孤电子对数为$\frac{5-1-4×1}{2}$=0,价层电子对数为2,杂化类型为sp3,H3O+中心原子是O,含有3σ键,孤电子对数为$\frac{6-1-3}{2}$=1,空间构型为正四面体,价层电子对数为4,为sp3杂化,空间构型为三角锥形;
②根据图(b)N5-中键总数为5个,根据信息,N5-的大π键可用符号Π56;
③O、N的非金属性较强,对应的O-H、N-H都可与H形成氢键;
(4)根据d=$\frac{m}{V}$=$\frac{\frac{y}{{N}_{A}×M}}{(a×1{0}^{-7})^{3}}$计算.
解答 解:(1)氮原子价层电子为最外层电子,即2s22p3,则电子排布图为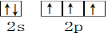 ,故答案为:
,故答案为: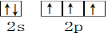 ;
;
(2)元素的非金属性越强,越易得到电子,则第一电子亲和能越大,同周期从左到右核电荷数依次增大,半径逐渐减小,从左到右易结合电子,放出的能量增大,N的最外层为半充满结构,较为稳定,不易结合一个电子,
故答案为:同周期从左到右核电荷数依次增大,半径逐渐减小,故结合一个电子释放出的能量依次增大;N的2p能级处于半充满状态,相对稳定,不易结合电子;
(3)①A.阳离子为H3O+和NH4+,NH4+中心原子N含有4个σ键,孤电子对数为$\frac{5-1-4×1}{2}$=0,价层电子对数为4,杂化类型为sp3,H3O+中心原子是O,含有3σ键,孤电子对数为$\frac{6-1-3}{2}$=1,价层电子对数为4,为sp3杂化;
B.由以上分析可知H3O+和NH4+中心原子的价层电子对数都为4;
C.NH4+为空间构型为正四面体,H3O+为空间构型为三角锥形;
D.含有的共价键类型都为σ键.
两种阳离子的相同之处为ABD,不同之处为C;
故答案为:ABD;C;
②根据图(b)N5-中键总数为5个,根据信息,N5-有6个电子可形成大π键,可用符号Π56表示,
故答案为:5;Π56;
③O、N的非金属性较强,对应的O-H、N-H都可与H形成氢键,还可表示为(H3O+)O-H…N、(NH4+)N-H…N,
故答案为:(H3O+)O-H…N、(NH4+)N-H…N;
(4)由d=$\frac{m}{V}$=$\frac{\frac{y}{{N}_{A}}×M}{(a×1{0}^{-7})^{3}}$可知,y=$\frac{d×(a×1{0}^{-7})^{3}×{N}_{A}}{M}$,故答案为:$\frac{d×(a×1{0}^{-7})^{3}×{N}_{A}}{M}$.
点评 本题为2017年考题,题目综合考查核外电子排布、元素周期律、轨道的杂化以及晶胞的计算、氢键等问题,侧重考查学生的分析能力和计算能力,题目难度中等,易错点为(3),注意把握氢键的形成.


科目:高中化学 来源: 题型:选择题
| 实验操作 | 目的或结论 | |
| A | 将Cu片放入FeC13溶液中 | 证明Fe的金属性比Cu强 |
| B | 将点燃的镁条置于盛有CO2的集气瓶中,瓶内壁有黑色固体生成 | 镁与CO2发生置换反应 |
| C | 将SO2通入溴水或酸性KMnO4溶液中 | 证明SO2有漂白性 |
| D | 向FeCl2溶液(含少量FeBr2杂质)中,加入适量氯水,再加CCl4萃取 分液 | 除去FeC12溶液中的FeBr2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
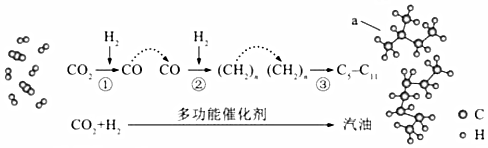
| A. | 反应①的产物中含有水 | B. | 反应②中只有碳碳键形成 | ||
| C. | 汽油主要是C5~C11的烃类混合物 | D. | 图中a的名称是2-甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅太阳能电池工作时,光能转化成电能 | |
| B. | 锂离子电池放电时,化学能转化成电能 | |
| C. | 电解质溶液导电时,电能转化成化学能 | |
| D. | 葡萄糖为人类生命活动提供能量时,化学能转化成热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸是一种重要的有机酸,常温下是具有刺激性气味的液体 | |
| B. | 乙酸的分子式为C2H4O2,与甲酸(HCOOH)互为同系物 | |
| C. | 乙酸不能被酸性高锰酸钾稀溶液氧化 | |
| D. | 乙酸官能团的结构式为-COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +
+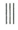 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$
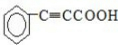 .
.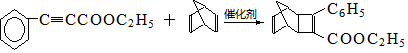 .
.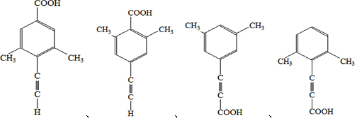 .
. 的合成路线
的合成路线 (其他试剂任选).
(其他试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为31的磷原子:3115P | B. | 氟原子的结构示意图: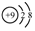 | ||
| C. | CaCl2的电子式: | D. | 明矾的化学式:Al2(SO4)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石的燃烧热比石墨的燃烧热小 | B. | 石墨一定不如金刚石稳定 | ||
| C. | 石墨的能量比金刚石的能量高 | D. | 由石墨制备金刚石一定是吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com