
将50 mL某未知浓度的AlCl3溶液分别加到60 mL 1 mol·L-1的NaOH溶液或60 mL 3 mol·L-1的NaOH溶液中,均能得到1.56 g Al(OH)3沉淀。则此AlCl3溶液的浓度可能是( )
A.1 mol·L-1 B.0.5 mol·L-1 C.0.6 mol·L-1 D.0.4 mol·L-1
A
【解析】
试题分析:由于两次加入的NaOH的物质的量不同,而产生的Al(OH)3沉淀相同,说明60 mL 1 mol·L-1的NaOH溶液不足量,产生的沉淀按照NaOH来计算,而60 mL 3 mol·L-1的NaOH溶液中NaOH的物质的量过量,根据方程式Al(OH)3+ OH-= AlO2-+ 2H2O,可知:1mol过量的NaOH能够溶解1mol的Al(OH)3,假设AlCl3的物质的量是n,则完全形成沉淀消耗NaOH物质的量是3n,过量的NaOH的物质的量是(0.18-3n)mol;溶解Al(OH)3的物质的量是(0.18-3n)mol,最后形成的沉淀的物质的量是:nmol- (0.18-3n)mol=(4n-0.18)mol=1.56 g÷78g/mol=0.02mol.解得n=0.05mol,因此AlCl3溶液的浓度可能是0.05mol÷0.05L=1mol/L,因此选项是A。
考点:考查AlCl3溶液的浓度的计算的知识。


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源:2014-2015学年江西省赣州市高一上学期第一次月考化学卷(解析版) 题型:填空题
松花蛋腌制配方有多种,但主要配料为生石灰(CaO)、纯碱和食盐。将一定比例的配料用水和黏土调制成糊状,敷于蛋上,密封保存,数日后即可食用。
(1)腌制松花蛋的配料用水调制时,发生的主要反应的化学方程式有(不考虑黏土中物质可能参与的反应)
。
(2)松花蛋外的糊状物经水溶解、过滤后,滤液中肯定大量含有的溶质为 和 ,可能含有的物质为Ca(OH)2或Na2CO3。
(3)某同学设计如下表所示实验方案,探究(2)所得滤液中可能含有的物质是否存在,请你帮他完善实验方案。
实验步骤 | 实验现象 | 结论 |
①取少量滤液,滴加适量K2CO3溶液 | 若出现白色沉淀 | 滤液中含Ca(OH)2 |
若无白色沉淀 | 滤液中无Ca(OH)2 | |
②取少量滤液, 。 | 若出现 。 | 滤液中含Na2CO3 |
问题讨论:在什么情况下可以不必做实验②就可以得出结论? 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省景德镇市高二上学期期中化学(理)试卷(解析版) 题型:填空题
(共10分) 甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。反应Ⅰ:CO(g)+2H2(g)  CH3OH(g),△H1
CH3OH(g),△H1
反应Ⅱ:C02(g)+3H2(g)  CH30H(g)+ H2O(g),△H2
CH30H(g)+ H2O(g),△H2
下表所列数据是反应I在不同温度下的化学平衡常数(K):
温度 | 250℃ | 300℃ | 350℃ |
K | 2.O | 0.27 | 0.012 |
(1)在一定条件下将2 molCO和6molH2充入2L的密闭容器中发生反应I,5min后测得c(CO)=0.4 mol/L,计算此段时间的反应速率(用H2表示) mol/(L·min)。
(2)由表中数据判断△H1 0(填“>”、“<”或“=”)反应C02(g)+H2(g) CO(g)+H20(g)△H3= (用△H1和△H2表示)。
CO(g)+H20(g)△H3= (用△H1和△H2表示)。
(3)若容器容积不变,下列措施可提高反应Ⅰ中CO转化率的是 (选字母)。
a.充入CO,使体系总压强增大
b.将CH3OH(g)从体系中分离
e.充入He,使体系总压强增大
d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:K= ;保持恒温恒容的条件下将反应Ⅱ的平衡体系各物质浓度均增加一倍,则化学平衡 (填“正向”、“逆向”或“不”)移动,平衡常数K (填“变大”、“变小”或“不变”)。
(5)这两种合成甲醇的方法比较,原子利用率较高的是 (填“Ⅰ”或“Ⅱ”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省景德镇市高二上学期期中化学(理)试卷(解析版) 题型:选择题
下列关于化学反应的自发性叙述中正确的是
A.焓变小于0而熵变大于0的反应肯定是自发的
B.焓变和熵变都小于0的反应肯定是自发的
C.焓变和熵变都大于0的反应肯定是自发的
D.熵变小于0而焓变大于0的反应肯定是自发的
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省高三上学期第二次月考化学试卷(解析版) 题型:实验题
(10分)氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程:
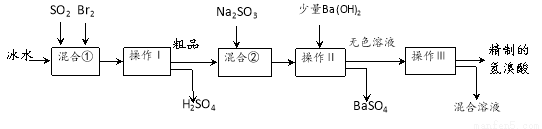
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为 。
(2)溴与氯能以共价键结合形成BrCl,BrCl的性质与卤素单质相似。则BrCl与水发生反应的化学方程式为 。
(3)操作Ⅱ的名称是 。操作Ⅲ一般适用于分离____________混合物。(选填编号)
A.固体和液体 B.固体和固体 C.互不相溶的液体 D.互溶的液体
(4)混合②中加入Na2SO3的目的是 。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为 . 乙同学取制得的氢溴酸少许,向其中加入CCl4,有机物层变为橙色,则证明在该溶液中含有_________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省高三上学期第二次月考化学试卷(解析版) 题型:选择题
如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )
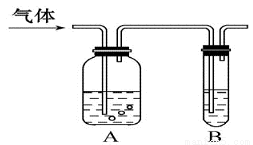
选项 | 气体 | A中试剂 | B中试剂 |
A | SO2、CO2 | 酸性KMnO4溶液 | 品红溶液 |
B | Cl2、HCl | 浓硫酸 | KI淀粉溶液 |
C | NH3、CO2 | 浓硫酸 | BaCl2试液 |
D | CO2、HCl | 饱和NaHCO3溶液 | AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省高三上学期第二次月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列叙述中正确的是( )
A.常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA
B.1L 1mol/L的盐酸溶液中,所含氯化氢分子数为NA
C.标准状况下,11.2L四氯化碳所含分子数为0.5 NA
D.在铜与硫的反应中,1mol铜完全反应失去的电子数为 NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省高一上学期第一次月考化学试卷(解析版) 题型:选择题
有一真空瓶质量为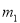 ,该瓶充入空气后质量为
,该瓶充入空气后质量为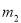 。在相同状况下,若改为充入某气体A时,总质量为
。在相同状况下,若改为充入某气体A时,总质量为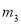 。则A的相对分子质量是( )
。则A的相对分子质量是( )
A.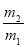 ×29 B.
×29 B.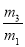 ×29 C.
×29 C.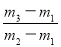 ×29 D.
×29 D.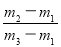 ×29
×29
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高二上学期期中化学试卷(选修)(解析版) 题型:选择题
“低碳经济”是以低能耗、低污染、低排放为基础的可持续发展经济模式。下列说法与“低碳经济”不符合的是
A.大力研发新型有机溶剂替代水作为萃取剂
B.加强对煤、石油、天然气等综合利用的研究,提高燃料的利用率
C.利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用
D.使用甲醇、乙醇混合型汽油可以减少对大气的污染
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com