



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ�� | �����Ϣ |
| X | X���γɻ�������������Ԫ�أ�����һ����̬�������ܲ�������ЧӦ |
| Y | Y�ǵؿ��к�������Ԫ�� |
| Z | Z��Y�γɵ�һ�ֻ�����Z2Y2Ϊ����ɫ��ĩ������Ϊ�����������������Դ |
| V | V�ĵ����ǵ���ɫ���壬�Ǻڻ�ҩ��һ����Ҫ�ɷ� |
| W | W�ĵ������������緢�ֺ�ʹ�õĽ���֮һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
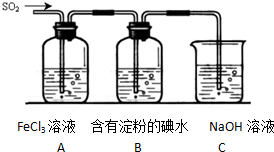
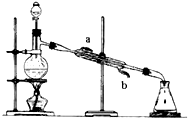 ��ͼ��ʾ������װ�ã���ʵ���Һϳ����������Ĵֲ�Ʒ����������ƿ�ڽ��������Ҵ�������Ũ�����ϣ�Ȼ��Һ©���ߵμӴ��ᣬ�������õ������Ҵ��������ˮ�����������ֲ�Ʒ��
��ͼ��ʾ������װ�ã���ʵ���Һϳ����������Ĵֲ�Ʒ����������ƿ�ڽ��������Ҵ�������Ũ�����ϣ�Ȼ��Һ©���ߵμӴ��ᣬ�������õ������Ҵ��������ˮ�����������ֲ�Ʒ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Cu+HNO3 ��Ũ����Cu ��NO3��2 | ||||
| B��Cu+HNO3 ��ϡ����Cu ��NO3��2 | ||||
C��Cu
| ||||
D��Cu
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ�� | �� | �� | �� |
| ��ʼͶ�� | 2molH2��1molCO | 1mol CH3OH | 4molH2��2molCO |
| ƽ��ʱn��CH3OH �� | 0.5mol | n2 | n3 |
| ��Ӧ�������仯 | �ų�Q1kJ | ����Q2kJ | �ų�Q3kJ |
| ��ϵ��ѹǿ | P1 | P2 | P3 |
| ��Ӧ���ת���� | ��1 | ��2 | ��3 |
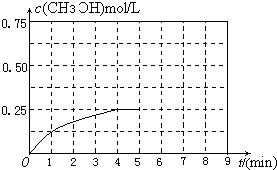
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com