
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器内,发生如下反应N2+3H2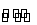 2NH3。
2NH3。
(1)若反应到某时刻t时,n(N2)=13 mol, n(NH3)=6 mol,a=_______。
(2)反应到达平衡时,混合气体体积为716.8 L(标准状况)其中NH3的含量(体积分数)为25%,计算平衡时NH3的物质的量_________。
(3)混合气体中a∶b=_________。
(4)平衡混合气体中n(N2)∶n(H2)∶n(NH3)=________。
(1)t时刻时,NH3生成6 mol
N2 + 3H2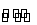 2NH3
2NH3
初始: a b 0
t时刻: 13 9 6
转化: a-13 b-9 6
所以:a-13=3,a=16
(2)平衡时n(NH3)=(716.8×25%)/22.4=8 (mol)。
(3)由化学方程式知生成8 mol NH3需消耗N2 4 mol,H212 mol
最后剩余N2∶16-4=12 (mol)
剩余H2为716.8/22.4-8 -12=
-12= 12 (mol)
12 (mol)
则开始通入H2为:b=12+12=24 (mol)
所以a∶b=16∶24=2∶3
(4)平衡时:n(N2)∶n(H2)∶n(NH3)=12∶12∶8=3∶3∶2。
答案:(1)16 (2)8 mol  (3)2∶3 (4)3∶3∶2
(3)2∶3 (4)3∶3∶2


科目:高中化学 来源: 题型:
Ⅰ.石墨烯[如图(甲)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(乙)所示]。
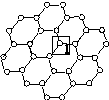
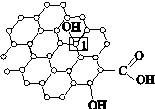
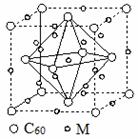
(甲)石墨烯结构 (乙)氧化石墨烯结构 (丙)
(1)图(甲)中,1号C与相邻C形成σ键的个数为________。
(2)图(乙)中,1号C的杂化方式是________,该C与相邻C形成的键角________(填“>”“<”或“=”)图(甲)中1号C与相邻C形成的键角。
(3)若将图(乙)所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有________(填元素符号)。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图(丙)所示,M原子位于晶胞的棱上与内部。该晶胞中M原子的个数为________,该材料的化学式为________。
Ⅱ.ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(5) H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
 ①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因: 。
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因: 。
②H2SeO4比H2SeO3酸性强的原因: 。
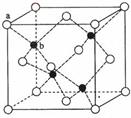
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如右图所示,其晶胞边长为540.0pm,其密度为
g/cm3(列式并计算),a位置S2-与b位置Zn2+之间的距离为 pm(列式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
x、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知
A.x的原子半径大于y的原子半径 B.x的电负性大于y的电负性
C.x的能层数性等于y的能层数 D.x的第一电离能小于y的第一电离能
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应N2(g)+3H2(g)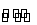 2NH3(g) ΔH<0,达到平衡后,为了使氢气的转化率增大,下列选项中采用的三种方法正确的是( )
2NH3(g) ΔH<0,达到平衡后,为了使氢气的转化率增大,下列选项中采用的三种方法正确的是( )
A.升高温度、降低压强、增加氮气
B.降低温度、增大压强、加入催化剂
C.升高温度、增大压强、增加氮气
D.降低温度、增大压强、分离出部分氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-浓度分别为a mol·L-1与b mol·L-1,则a和b的关系为( )
A.a>b B.a=10-4b C.b=10-4a D.a=b
查看答案和解析>>
科目:高中化学 来源: 题型:
有①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液各25 mL,物质的量浓度均为0.1 mol/L,下列说法正确的是( )
A.3种溶液pH的大小顺序是③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25 mL 0.1 mol·L-1的盐酸后,pH最大的是①
D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用下列仪器,以乙醇、浓硫酸和溴为原料制备1,2二溴乙烷。已知1,2二溴乙烷熔点为9 ℃,C2H5OH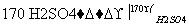 CH2===CH2↑+H2O。
CH2===CH2↑+H2O。
2C2H5OH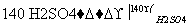 C2H5—O—C2H5+H2O
C2H5—O—C2H5+H2O
(乙醚)
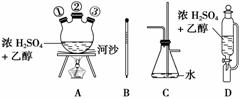

(1)如果气体流向为从左到右,正确的连接顺序是(短接口或橡皮管均已略去):B经A①插入A中,D接A②;A③接________接________接________接________。
(2)装置A中反应器的名称为________,仪器D的名称为________,河沙的作用为________。
(3)写出仪器C的两个作用:________________________________________________。
(4)温度计水银球的正确位置是_________________________________________________。
(5)反应管E中加入少量水及把反应管E置于盛有冷水的小烧杯中是因为________________________________________________________________________。
(6)若产物中有少量未反应的Br2,最好用________(填正确选项前的字母)洗涤除去。
a.饱和亚硫酸氢钠溶液
b.氢氧化钠溶液
c.碘化钠溶液
d.乙醇
(7)产品中可能会有的有机杂质是______,可用________方法除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示:
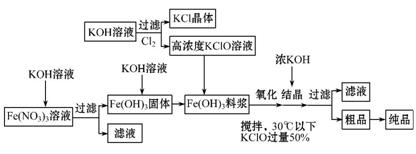
(1)上述氧化过程中,发生反应的离子方程式是 ,
控制反应温度30℃以下的原因是 。
(2)结晶过程中加入浓KOH溶液的作用是 。
(3)已知常温下Ksp[Fe(OH)3]=1.25×10-36,则Fe(NO3)3溶液中加入KOH溶液到
pH= 时,Fe3+才能完全沉淀(当溶液中某种离子浓度小于10-5mol·L-1时可看作完全沉淀,lg2=0.3,lg5=0.7),常温下反应Fe3++3H2O Fe(OH)3+3H+的平衡常数K= [水解生成的Fe(OH)3为胶体,其浓度不代入计算式,写出计算结果]。
Fe(OH)3+3H+的平衡常数K= [水解生成的Fe(OH)3为胶体,其浓度不代入计算式,写出计算结果]。
(4)最近,工业上用表面附有铁的氧化物的铁丝网作阳极,电解KOH溶液制备K2FeO4,优点是原料价廉,效率高。若用一表面附有Fe3O4的铁丝网20.0 g作阳极电解,当电路中通过1.4 mol电子时,铁丝网恰好电解完全。此时生成K2FeO4的质量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com