
【题目】2016年冬季全国大部分地区出现雾霾现象,汽车尾气是造成雾霾的原因之一,汽车尾气含CO、NO等有毒气体。为了减少CO 对大气的污染,某研究性学习小组拟研究CO和H2O 反应转化为绿色能源H2。己如:
2CO(g)+O2(g)=2CO2(g); △H= -566kJ·moL-1
2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ·moL-1
H2O(g)=H2O(l) △H= -44.0kJ·moL-1
(1)氢气燃烧热△H=_____________________。
(2)写出CO 和H2O(g)作用生成CO2 和H2的热化学方程式______________________。
(3)往1L 体积不变的容器中加入0.200molCO和1.00molH2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1(方程式中各物质前化学计量数为最简整数比),则t℃时CO的转化率为____________;反应达到平衡后,升高温度,此时平衡常数将____________(填“变大”、“ 不变”或“变 小”)。
(4)从汽车尾气中分离出CO 与O2、与熔融盐Na2CO3组成燃料电池,同时采用电解法制备N2O5,装置如下图所示,其中Y为CO2。写出石墨Ⅰ电极上发生反应的电极反应式________________。在电解池中生成N2O5的电极反应式为______________________。
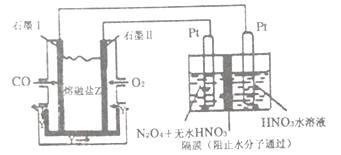
(5)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。下图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则:
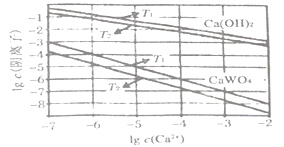
T1___________T2 (填“>”或“<”),T1时Ksp (CaWO4)=________。
【答案】-285.8 kJ·moL-1 CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.2KJ·moL-1 83.3% 减小 CO+CO32--2e- = 2CO2 N2O4 +2HNO3-2e- = 2N2O5+2H+ < 1×10-10(mol/L)2
【解析】
试题(1)氢气的燃烧热是1mol氢气完全燃烧生成液态水放出的热量,根据盖斯定律计算氢气燃烧热;(2)根据盖斯定律计算CO和H2O(g)作用生成CO2和H2的焓变;(3)利用“三段式”计算CO的转化率;CO和H2O(g)作用生成CO2和H2正反应放热,升高温度平衡逆向移动;(4)CO与O2、熔融盐Na2CO3组成燃料电池,CO发生氧化反应,通入CO的一极是负极;电解池中N2O4失电子发生氧化反应生成N2O5;(5)溶解度均随温度升高而减小,温度越低离子浓度越大;T1时Ksp(CaWO4)=![]() ;
;
解析:(1)①2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ·moL-1
②H2O(g)=H2O(l) △H=-44.0kJ·moL-1 ;根据盖斯定律①+②×2得2H2(g)+O2(g)=2H2O(l); △H=-571.6kJ·moL-1,氢气的燃烧热是1mol氢气完全燃烧生成液态水放出的热量,所以氢气燃烧热△H= -285.8 kJ·moL-1;
(2)①2CO(g)+O2(g)=2CO2(g); △H=-566kJ·moL-1
②2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ·moL-1
根据盖斯定律①![]() -②
-②![]() 得CO(g)+H2O(g)=CO2(g)+H2(g) ΔH= - 41.2KJ·moL-1;
得CO(g)+H2O(g)=CO2(g)+H2(g) ΔH= - 41.2KJ·moL-1;
(3)
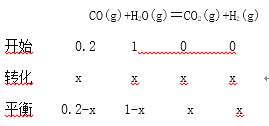
![]()
X=![]() ;则t℃时CO的转化率为
;则t℃时CO的转化率为![]()
![]() 83.3%;CO和H2O(g)作用生成CO2和H2正反应放热,升高温度平衡逆向移动,平衡常数减小;(4)CO与O2、熔融盐Na2CO3组成燃料电池,通入CO的一极是负极,CO失电子发生氧化反应生成二氧化碳,电极反应为CO+CO32--2e- = 2CO2;电解池中N2O4失电子发生氧化反应生成N2O5,电解池中生成N2O5的电极反应式为N2O4 +2HNO3-2e- = 2N2O5+2H+;(5)溶解度均随温度升高而减小,温度越低离子浓度越大,所以T1<T2;T1时Ksp(CaWO4)=
83.3%;CO和H2O(g)作用生成CO2和H2正反应放热,升高温度平衡逆向移动,平衡常数减小;(4)CO与O2、熔融盐Na2CO3组成燃料电池,通入CO的一极是负极,CO失电子发生氧化反应生成二氧化碳,电极反应为CO+CO32--2e- = 2CO2;电解池中N2O4失电子发生氧化反应生成N2O5,电解池中生成N2O5的电极反应式为N2O4 +2HNO3-2e- = 2N2O5+2H+;(5)溶解度均随温度升高而减小,温度越低离子浓度越大,所以T1<T2;T1时Ksp(CaWO4)=![]() =
=![]() (mol/L)2 ;
(mol/L)2 ;


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组模拟工业制漂白粉,设计了下列图的实验装置。已知:①氯气和碱反应放出热量。②6Cl2+6Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O。
5CaCl2+Ca(ClO3)2+6H2O。
回答下列问题:
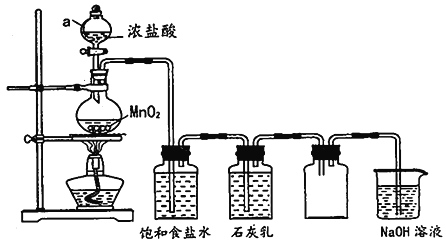
(1)甲装置中仪器a的名称是_____________________。
(2)装置乙中饱和食盐水的作用是_____________________。
(3)①制取漂白粉的化学方程式是______________________________。
②该小组制得的漂白粉中n(CaCl2)远大于n[Ca(ClO)2],则产物中还混杂有物质的化学式是_____。
③为提高Ca(ClO)2的含量,可采取的措施是__________________(任写一种即可)。
(4)漂白粉应密封保存,原因是______________(用化学方程式表示)。
(5)家庭中常用84 消毒液(主要成分NaClO)、洁厕灵(主要成分盐酸)清洁卫生。两者同时混合使用会产生有毒的氯气,写出该反应的离子方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物能形成酸雨和光化学烟雾,严重污染环境。燃煤和机动车尾气是氮氧化物的主要来源。现在对其中的一些气体进行了一定的研究:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) △H= 574 kJ·moll
4NO(g)+CO2(g)+2H2O(g) △H= 574 kJ·moll
②CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) △H= 1160 kJ·moll
2N2(g)+CO2(g)+2H2O(g) △H= 1160 kJ·moll
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式______________________________________________________。
(2)在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体。T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,在一定条件下发生反应,反应过程中NO的物质的量随时间变化如图所示。
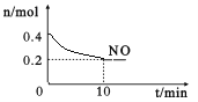
①写出该反应的化学方程式______________________________________。
②10 min内该反应的速率v(CO)=__________________;T℃时,该化学反应的平衡常数K=_______。
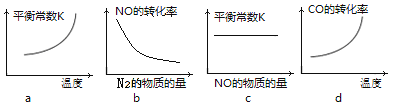
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是____________。(填序号)
④一定温度下,在恒容密闭容器中充入一定量NO和CO进行该反应,下列选项能判断反应已达到化学平衡状态的是____________。
a.容器中压强不再变化 b.CO2的浓度不再变化
c.2v正(NO)=v逆(N2) d.气体的密度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香草醛是香荚兰豆的香气成分中含有的物质,其结构简式为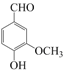 。
。
(1)香草醛含有的含氧官能团有羟基和_______。
(2)香草醛与足量Na2CO3溶液反应的化学方程式为_____________。
(3)香草醛与新制Cu(OH)2反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数值。下列说法正确的是
A. 标准状况下,11.2L的甲醇所含的氢原子数等于2NA
B. 25℃时,Ksp(BaSO4)=1×10-10,则BaSO4饱和和溶液中Ba2+数目为1×10-5NA
C. 常温常压下,Na2O2与H2O反应生成1molO2时,转移电子数是2 NA
D. 1L1mol·L-1AlCl3溶液中含有的Al3+数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在NaCl溶液中滴加AgNO3溶液,现象为_____________________________ , 离子方程式为:_________________________________________________
(2)在CH3CH2CH2Cl中滴加AgNO3溶液,现象为_____________________________,原因是__________________________
(3)若先将CH3CH2CH2Cl与NaOH溶液共热,然后用硝酸酸化,再滴加AgNO3溶液,现象为_______________________________________________________,反应的化学方程式为:________________________,______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究“地康法制氯气”的原理并验证Cl2的性质,设计实验如下(夹持装置略去)请回答下列问题:
Ⅰ.Cl2的制备。
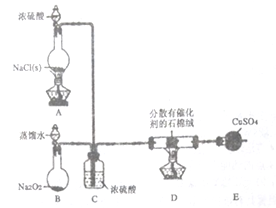
(1)装置B中发生反应的化学方程式为________________。
(2)装置C的作用除干燥气体外还有______________________。
(3)装置E中盛放CuSO4的仪器名称为___________;反应开始后,硫酸铜变蓝,则装置D中发生反应的化学方程式为________________。
Ⅱ.Cl2性质的验证。
该小组用实验Ⅰ中制得的Cl2和如图所示装置(不能重复使用)依次验证干燥纯净的Cl2无漂白性、湿润的Cl2有漂白性、Cl的非金属性强于S
查阅资料:
①PdCl2溶液捕获CO时,生成金属单质和两种酸性气体化合物,同时,溶解度大的气体难逸出;
②少量CO2不干扰实验;
③该实验条件下,C与Cl2不反应。
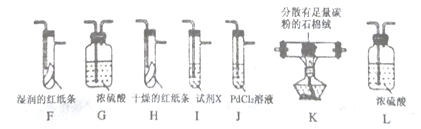
(4)按气流从左到右的方向,装置连接的合理顺序为
E→G→K→ → → → → →尾气处理(填装置字母)。_________
(5)试剂X的名称为_______________。
(6)装置J中发生反应的化学方程式为______________。
(7)设计实验证明经净化后的Cl2中不含HCl:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香化合物A是一种基本化工原料,可以从煤和石油中得到。A、B、C、D、E的转化关系如图所示:
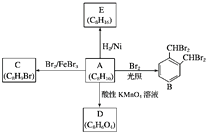
回答下列问题:
(1)A的化学名称是________;E属于________(填“饱和烃”或“不饱和烃”)。
(2)A→B的反应类型是__________,在该反应的副产物中,与B互为同分异构体的副产物的结构简式为________________。
(3)A→C的化学方程式为________________________________________________。
(4)A与酸性KMnO4溶液反应可得到D,写出D的结构简式:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com