
【题目】下列关于苯的说法中正确的是
A. 苯分子中6个碳原子之间的化学键完全相同
B. 苯分子中含有碳碳双键,能使酸性高锰酸钾溶液褪色
C. 在催化剂存在下,苯能与溴水发生取代反应,生成溴苯
D. 苯是一种密度比水大,不溶于水的有特殊气味的无色液体
科目:高中化学 来源: 题型:
【题目】下列两种物质发生反应 ①Na和O2②AlCl3与氨水 ③水玻璃与CO2④Fe与Cl2⑤Fe和稀HNO3,因反应物用量或反应条件的不同而生成不同产物的是( )
A.①②③④⑤B.①②③⑤C.①②⑤D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种主族元素,它们在周期表中位置如图所示,下列说法正确的是
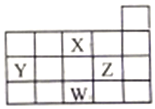
A. X、Y、Z三种元素的原子半径依次增大 B. X元素的氢化物稳定性比Y元素的弱
C. 化合物YZ4和氨气反应可以生成Y单项 D. 氢化物沸点: W>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.十氢萘是具有高储氢密度的氢能载体,经历“十氢萘(C10H18)→四氢萘(C10H12)→萘(C10H8)”的脱氢过程释放氢气。已知:
C10H18(l)![]() C10H12(l)+3H2(g) △H1
C10H12(l)+3H2(g) △H1
C10H12(l)![]() C10H8(l)+2H2(g) △H2
C10H8(l)+2H2(g) △H2
△H1>△H2>0;C10H18→C10H12的活化能为Ea1,C10H12→C10H8的活化能为Ea2,十氢萘的常压沸点为192℃;在192℃,液态十氢萘的脱氢反应的平衡转化率约为9%。请回答:
(1)有利于提高上述反应平衡转化率的条件是_________。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(2)研究表明,将适量的十萘奈置于恒容密闭反应器中,升高温度带来高压,该条件下也可显著释氢,理由是______________________________________________________。
(3)温度335℃,在恒容密闭反应器中进行高压液态十氢萘(1.00 mol)催化脱氢实验,测得C10H12和C10H8的产率x1和x2(以物质的量分数计)随时间变化关系,如图1所示。


①在8 h时,反应体系内氢气的量为__________mol(忽略其他副反应)。
②x1显著低于x2的原因是________________________________________。
③在图2中绘制“C10H18→C10H12→C10H8”的“能量~反应过程”示意图。
Ⅱ.科学家发现,以H2O和N2为原料,熔融NaOH-KOH为电解质,纳米Fe2O3作催化剂,在250℃和常压下可实现电化学合成氨。阴极区发生的变化可视为按两步进行,请补充完整。
(4)电极反应式:________________________________和2Fe+3H2O+N2=Fe2O3+2NH3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃、101kPa下,断开1mol H2中的化学键需吸收436kJ的热量,断开1mol Cl2中的化学键需吸收243kJ的热量,断开1mol HCl分子中的化学键需吸收431kJ的热量,试求5mol H2和5mol Cl2完全反应的能量变化为kJ(填“吸收或放出”+能量数值).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究温度对酶活性的影响,某生物兴趣小组设计了如下实验方案。
①取6支试管,分别向其中加入4mL淀粉溶液;
②将试管分别放入0℃、20℃、40℃、60℃、80℃、100℃的恒温水浴锅中保温5min;
③向装有淀粉溶液的试管中滴加2滴淀粉酶溶液,立即放回水浴锅中并计时;
④每隔1分钟取2滴左右淀粉溶液,滴于多孔反应板上,滴加1滴碘液检测。记录取出的样液遇碘不呈蓝色所需的时间t。
分析回答下列问题:
(1)该实验的自变量是________________________________。
(2)不能选择过氧化氢酶和过氧化氢溶液进行探究,是因为_____________________________。
(3)该方案中淀粉酶溶液滴加2滴,不能过多,主要是为了避免___________________________。
(4)记录的实验结果如下表(“—”表示没有记录到实验结果):
温度 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
平均时间t | — | 7min | 3min | 2min | 7min | — |
请根据表中信息,用柱形图的形式表示温度对该酶活性的影响。___________________________。

实验结果表明该淀粉酶的最适温度范围是_______________。为进一步确定最适温度,需要________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生探究0.25mol/L Al2( SO4)3溶液与0.5mol/L Na2CO3溶液的反应,实验如下:

下列分析不正确的是
A. 实验I中,白色沉淀a是Al(OH)3
B. 实验2中,白色沉淀b含有CO32-
C. 实验l、2中,白色沉淀成分不同的原因与混合后溶液的pH无关
D. 检验白色沉淀a、b足否洗涤干净,均可用盐酸酸化的BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性硼化钒(VB2)—空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5,用该电池电解100mL 硫酸铜溶液,实验装置如图所示(b、c均为惰性电极),当外电路中通过0.02mol电子时,B装置两极共收集到0.224L气体(标准状况)。下列说法正确的是( )
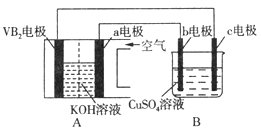
A. 电解过程中,b电极表面先有红色物质析出,然后有气泡产生
B. VB2为负极,电极反应为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+
C. 电池内部OH-移向a电极,溶液pH保持增大
D. 忽略溶液体积变化,电解后B装置中溶液的pH为1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com