
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g)
M(g)+N(g)
所得实验数据如下表:
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
回答下列问题:
(1)实验①中,若5min时测得,n(M)=0.050mo1, 则0至5min时间内,用N表示的平均反应速率为________。
(2)实验③平衡常数为___________,该正反应为____________反应(填“吸热”或“放热”)
(3)能说明上述反应一定达到平衡的条件是_______________________。
A. c(Y)= c(N) B.平均分子量不再变化
C. v正(X) =v逆(M) D.温度和压强一定时,混合气体的密度不再变化
(4)实验③中,达到平衡时,X的转化率为_________________________。
(5)实验③、④中,达到平衡时,a与b的关系为__________(填选项),请解释原因________________。
A. a>2b B. a=2b C.b<a<2b D.a<b
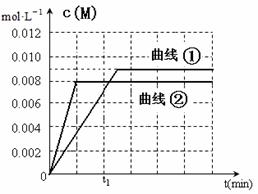
(6)图是实验①中c(M)随时间变化的曲线图,请在图中画出实验②中c(M)随时间变化的曲线图。

【知识点】化学平衡常数和化学平衡的移动G1 G2 G4
【答案解析】(1)0.001mol·L-1·min-1 (2分,数值对单位不写扣1分)
(2)1 (2分) 放热(1分)
(3)C (2分)
(4)60% (2分)
(5)A(1分) 若温度不变,则b = a /2,该反应为放热反应,温度升高,平衡向逆反应方向移动,故b <a /2,即a > 2b(2分)
(6)(2分)(曲线②达平衡时间小于t1且c(M)=0.008才得分)
解析:(1)实验①中,若5min时测得n(M)=0.050mol,浓度是0.0050mol/L,则根据反应的化学方程式可知,同时生成的N的物质的量也是0.0050mol/L ,因此0至5min时间内,用N表示的平均反应速率υ(N)=0.0050mol/L ÷5min=0.001mol·L-1·min-1 ,
(2)实验③与实验②温度相同,所以实验③平衡常数与实验②中平衡常数相同,平衡时M的浓度是0.0080mol/L,则同时生成的N的浓度是0.0080mol/L,消耗X与Y的浓度均是0.0080mol/L,因此平衡时X和Y的浓度分别为0.01mol/L-0.0080mol/L=0.002mol/L,0.04mol/L-0.0080mol/L=0.032mol/L,因此反应的平衡常数k=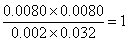 ;相同方法计算①的平衡常数k=
;相同方法计算①的平衡常数k=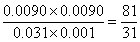 ,可见升温平衡常数减小,即平衡左移,正反应为放热反应;
,可见升温平衡常数减小,即平衡左移,正反应为放热反应;
(3)A. c(Y)= c(N)不能说明正逆速率相等,不能说明反应一定达到平衡 ;B.反应物生成物全是气体,且反应前后物质的量不变,无论平衡是否移动平均分子量都不变化,不能说明反应一定达到平衡;
C. v正(X) =v逆(M) ,能说明反应一定达到平衡 ; D.温度和压强一定时,无论平衡是否移动混合气体的密度都不变化,不能说明反应一定达到平衡 ;只有C符合题意。
(4)设实验③中,达到平衡时,X减小的浓度为x
X(g) + Y(g) M(g)+N(g)
M(g)+N(g)
开始 0.02mol/L 0.03mol/L 0 0
x x x x
平衡0.02mol/L-x 0.03mol/L-x x x
代入平衡常数表达式,利用k=1,解得x=0.012mol/L,X的转化率为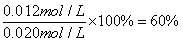
(5)实验③、④中,若温度不变构成等效平衡,则b = a /2,该反应为放热反应,温度升高,平衡向逆反应方向移动,故b <a /2,即a>2b 。
(6)根据升高温度反应速率加快,实验②中应该先达平衡,平衡时M的浓度为0.008mol/L,满足以上两点画图即可。
【思路点拨】本题考查了化学平衡常数和化学平衡的移动,运用同一温度下化学平衡常数不变可以顺利解决问题。


科目:高中化学 来源: 题型:
下列有关说法正确的是
A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
B.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0
C.加热0.1mol/LNa2CO3溶液,CO32-的水解程度和溶液的pH均增大
D.对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠( Na2S2O3)可用做分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3 +CO2制得。实验室模拟该工业过程的装置如图所示。
回答下列问题:
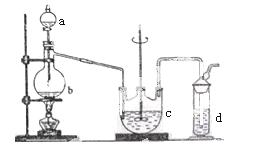
(1)b中反应的离子方程式为__________________,c中试剂为_______________ ______。
______。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是____________________。
(3)d中的试剂为____________。
(4)实验中要控制SO2生成速率,可以采取的措施有______________________(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上研究燃料脱硫的过程中,涉及如下反应:
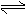 CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g),K1,△H1= 218.4 kJ·mol-l(反应I)
CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g),K1,△H1= 218.4 kJ·mol-l(反应I)

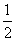 CaSO4(s)+2CO(g)
CaSO4(s)+2CO(g) 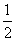 CaS(s)+2CO2(g),K2,△H2= -87.8 kJ·mol-l(反应II)
CaS(s)+2CO2(g),K2,△H2= -87.8 kJ·mol-l(反应II)
 (1)反应CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g)的△H= ;平衡常数K= (用K1,K2表示)。
(1)反应CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g)的△H= ;平衡常数K= (用K1,K2表示)。
(2)某温度下在一密闭容器中若只发生反应I,测得数据如下:

前100 s 内v(SO2)= mo1·L-1·s-l,平衡时CO的转化率为 。
(3)若只研究反应II,在不同条件下其反应能量变化如下图所示:图中曲线a到曲线b的措施是________,恒温恒容时,下列说法能说明反应Ⅱ到达平衡状态的是____ 。

A.体系中气体的平均摩尔质量不再改变
B.v(CO)=v(CO2)
C.CO的转化率达到了最大限度
D.体系内气体压强不再发生变化
(4)某科研小组研究在其它条件不变的情况下,改变起始一氧化碳物质的量[用n(CO)表示]对CaO(s)+3CO(g)+SO2(g)
 CaS(s)+3CO2(g)反应的影响,实验结果如右图所示(图中T表示温度):
CaS(s)+3CO2(g)反应的影响,实验结果如右图所示(图中T表示温度):
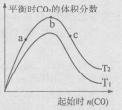
①比较在a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是____ 。
②图像中T2 T1(填“高于”、“低于”、“等于”或“无法确定”):判断的理由是____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是关于反应A2(g)+3B2(g)  2C(g)(正反应为放热反应)
2C(g)(正反应为放热反应)
的平衡移动图形,影响平衡移动的原因是
A.升高温度,同时加压
B.降低温度,同时减压
C.增大反应物浓度,同时使用适宜的催化剂
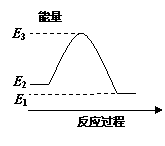 D.增大反应物浓度,同时减小生成物浓度
D.增大反应物浓度,同时减小生成物浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
向某恒容密闭容器中充入一定量CO2和H2,发生反应:CO2(g)+ H2(g)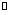 HCOOH(g),测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示。下列物理量中,a点大于b点的是
HCOOH(g),测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示。下列物理量中,a点大于b点的是
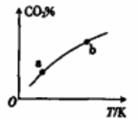
A. 正反应速率
B. 逆反应速率
C. HCOOH(g)的浓度
D. H2的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA代表阿伏加德罗常数的值,下列说法中正确的是
A.1L 1mol·L-1的CH3COOH溶液中含有NA个氢离子
B.含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol·L-1
C.0.1mol金属钠在过量氧气中充分燃烧,生成的化合物中离子总数为0.15NA
D.在VLCO和NO的混合气体中含有的氧原子个数为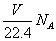
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值。下列叙述正确的是
A.常温常压下,46g NO2与N2O4的混合气体中含有的分子总数为NA
B.0.1mol乙烯和乙醇的混合物完全燃烧所消耗O2的分子数为0.3NA
C.25。C时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1 NA
D.一定量的钠与8g氧气作用,若两者均无剩余,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
将等物质的量的A和B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g),经5 分
钟后,测得 D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,C的平均反应速率是0.1 mol·L-1·min-1。A在5
D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,C的平均反应速率是0.1 mol·L-1·min-1。A在5
min末的浓度是________,B的平均反应速率是________,D的平均反应速率是________,x的值是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com