
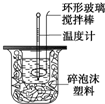
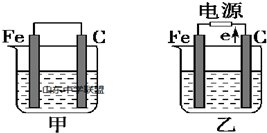
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温 度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
分析 (1)中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,根据热化学方程式的书写方法写出热化学方程式;
(2)将NaOH溶液倒入小烧杯中,不能分几次倒入,否则会导致热量散失,影响测定结果;
(3)硫酸和氢氧化钠混合时,用套在温度计上的环形玻璃搅拌棒轻轻地搅动,使硫酸与NaOH溶液混合均匀;
(4)①先判断温度差的有效性,然后求出温度差平均值;
②根据Q=m•c•△T计算反应放出的热量,最后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热;
③a.装置保温、隔热效果差,测得的热量偏小;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量不变,但温度差偏小;
c.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,减少热量损失;
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,酸碱反应放热,硫酸的起始温度偏高.
(5)根据盖斯定律写出白磷转化为红磷的焓变,书写热化学方程式;
解答 解:(1)强酸、强碱的中和热为-57.3kJ/mol,中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,稀硫酸和稀氢氧化钠溶液反应的热化学方程式为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ•mol-1;
故答案为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ•mol-1;
(2)倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果;
故选C;
(3)使硫酸与NaOH溶液混合均匀的正确操作方法是:用套在温度计上的环形玻璃搅拌棒轻轻地搅动;温度计是测量温度的,不能使用温度计搅拌;也不能轻轻地振荡烧杯,否则可能导致液体溅出或热量散失,影响测定结果;更不能揭开硬纸片用玻璃棒搅拌,否则会有热量散失;
故选D;
(4)①4次温度差分别为:3.4℃,5.1,3.3℃,3.5℃,第2组数据无效,温度差平均值为3.4℃;
故答案为:3.4℃;
②50mL 0.25mol/L硫酸与50mL 0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol/L×2=0.025mol,溶液的质量为100ml×1g/ml=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-$\frac{1.4212kJ}{0.025mol}$=-56.8kJ/mol;
故答案为:-56.8 kJ•mol-1;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量不变,但温度差偏小,中和热的数值偏小,故b正确;
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失,中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,酸碱反应放热,硫酸的起始温度偏高,温度差偏小,中和热的数值偏小,故d正确.
故答案为:abcd;
(5)已知:P4(白磷,s)+5O2(g)═P4O10(s)△H=-2983.2kJ/mol ①
P(红磷,s)+$\frac{5}{4}$O2(g)═$\frac{1}{4}$P4O10(s)△H=-738.5kJ/mol ②
根据盖斯定律:①-②×4可得:P4(s,白磷)=4P(s,红磷)△H=(-2983.2kJ/mol)-(-738.5kJ)×4=-29.2kJ/mol,
故答案为:P4(白磷,s)=4 P(红磷,s)△H=-29.2 kJ/mol.
点评 本题主要考查热化学方程式以及反应热的计算,题目难度大,注意理解中和热的概念、把握热化学方程式的书写方法,以及测定反应热的误差等问题.


科目:高中化学 来源: 题型:解答题
| 体系 | c(SO2) mol/L | c(O2) mol/L | c(SO3) mol/L | 反应方向 |
| (1) | 0.0600 | 0.400 | 2.000 | |
| (2) | 0.0960 | 0.300 | 0.500 | |
| (3) | 0.0862 | 0.263 | 1.020 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-+H2O?H3O++CO32- | B. | NH3+H2O?NH4++OH- | ||
| C. | CO32-+2H2O?H2CO3+2OH- | D. | Al3++3H2O?Al(OH)3+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ):
):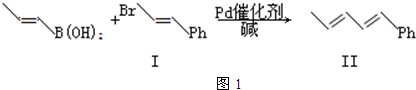
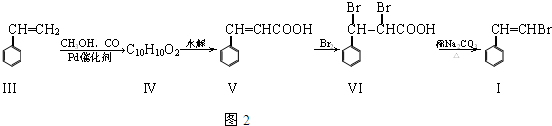
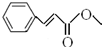 ;
; .
.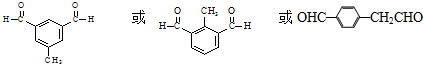 .
.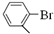 )与化合物【
)与化合物【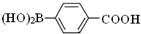 】也能发生类似反应①的偶联反应,写出产物的结构简式
】也能发生类似反应①的偶联反应,写出产物的结构简式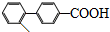 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铁片和稀硫酸反应制氢气时,可改用98%的浓硫酸加快生成氢气速率 | |
| B. | 100 mL 2 mol•L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 | |
| C. | 汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 | |
| D. | SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以地沟油为原料加工制成的生物柴油的成分与从石油分馏得到的柴油成分不同 | |
| B. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
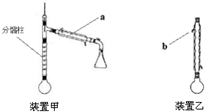 乙酰苯胺是常用的医药中间体,可由苯胺与乙酸制备.反应的化学方程式如下:
乙酰苯胺是常用的医药中间体,可由苯胺与乙酸制备.反应的化学方程式如下: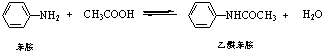
| 化合物 | 密度(g.cm-3) | 溶解性 | 熔点(℃) | 沸点(℃) |
| 乙酸 | 1.05 | 易溶于水、乙醇 | 17 | 118 |
| 苯胺 | 1.02 | 微溶于水,易溶于乙醇 | -6 | 184 |
| 乙酰苯胺 | - | 微溶于冷水,可溶于热水,易溶于乙醇 | 114 | 304 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验过程 |
| A | 证明构成原电池能加快制取氢气速率 | 在锌与稀硫酸反应时加足量氧化铜 |
| B | 证明负极发生氧化反应,正极发生还原反应 | 将锌片、铜片分别放入硫酸铜溶液中 |
| C | 证明电极类型与电解质溶液有关 | 以铝、镁为电极,分别在氢氧化钠溶液、稀硫酸中构成原电池 |
| D | 证明Ag+的氧化性比Cu2+强 | 以石墨为电极,电解0.001mol•L-1AgNO3溶液和1mol•L-Cu(NO3)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com