
. |
| M |
| m |
| n |
| 1mol×32g/mol |
| 1mol×32g/mol+3mol×28g/mol |
| 1mol×32g/mol+1.5mol×16g/mol |
| 1mol×32g/mol+3mol×28g/mol |
| ||
| ||
| 71g+32g |
| 2mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、Fe分别与氯气和稀盐酸反应所得氯化物相同 |
| B、铁粉中混有铝粉既可用过量的NaOH溶液,也可以用过量FeCl3充分反应过滤除去 |
| C、Li、Na、K的原子半径和密度随原子序数的增加而增大 |
| D、最外层电子数为2的元素不一定位于周期表中第二纵行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 | B、3 | C、4 | D、5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
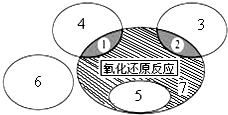 (1)如图是课本中“四种基本反应类型与氧化还原反应的关系”图,“H2+CuO
(1)如图是课本中“四种基本反应类型与氧化还原反应的关系”图,“H2+CuO
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
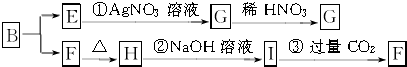
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单质钠的密度比钾的密度小 |
| B、Na+和K+常用作氧化剂 |
| C、钠和钾都是短周期元素 |
| D、钠和钾的合金[ω(K)=50%~80%]在室温下呈液态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com