
【题目】698 K时,向某V L的密闭容器中充入2 mol H2(g)和2 mol I2(g),发生反应:H2(g)+I2(g)2HI(g) ΔH=-26.5 kJ·mol-1,测得各物质的物质的量浓度与时间的变化关系如图所示。
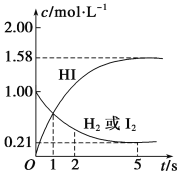
该反应达到平衡状态时,______(填“吸收”或“放出”)的热量为:____kJ。
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】某研究小组探究氨基甲酸铵(NH2COONH4)分解的化学平衡和水解反应速率。
(1)将一定量纯净的氨基甲酸铵置于固定容积为 100mL 的密闭真空溶液 A 中,在恒定温度下使其达到分解 平衡。实验测得不同温度下的平衡数据列于下表:
温度(℃) | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总物质的量(mol) | 0.34 | 0.48 | 0.68 | 0.94 |
①氨基甲酸铵分解的化学方程式为 NH2COONH4(s) 2NH3(g)+CO2(g),若 25.0℃时达到平衡所用时间为8min,根据数据计算 NH3 的平均生成速率为__________。
②可以判断该分解反应已经达到化学平衡的是_____。
A. 2v(NH3)正=v(CO2)逆
B.密闭容器中总压强不变
C. 密闭容器中混合气体的密度不变
D. 密闭容器中氨气的体积分数不变
(2)已知:NH2COONH4+2H2O NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵 溶液测定水解反应速率,得到 c(NH2COO-)随时间变化趋势如图所示。根据图中信息,如何说明水解反应速率随温度升高而增大:_____。

(3)合成氨工业对国民经济和社会发展具有重要意义。工业合成氨常用的催化剂是_____,氨分子的电子式是_____。
(4)如图是一定的温度和压强下时 N2 和 H2 反应生成 1molNH3 过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:__________________________。(热量 Q 的数值使用含字母 a、b 的代数式表示)

(5)在催化剂存在下,NH3 可用来消除 NO 的污染,生成两种对环境无害的物质。写出反应的化学方程式:_____________________;该反应中氧化产物与还原产物的物质的量之比是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可以发生以下反应:2N2O5(g) ![]() 4NO2(g)+O2(g) △H>0,T1温度时,向密闭容器中通入N2O5,部分实验数据见表:
4NO2(g)+O2(g) △H>0,T1温度时,向密闭容器中通入N2O5,部分实验数据见表:
![]()
下列说法中不正确的是
A.500s内N2O5分解速率为2.96×10-3mol·L-1·s-1
B.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1 >T2,则K1>K2
D.平衡后,其他条件不变,将容器体积压缩到原来的![]() ,则c(NO2)<5.00mol·L-1
,则c(NO2)<5.00mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL0.1000mol·L-1CH3COOH溶液中慢慢加入NaOH固体。CH3COOH与CH3COO-的浓度变化趋势如图所示(不考虑溶液体积和温度的变化)。n(NaOH)=0.001mol时,溶液呈酸性。下列说法正确的是
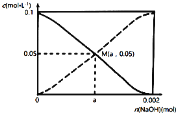
A.当n(NaOH)=0.002mol时,c(CH3COO-)>c(Na+)>c(CH3COOH)
B.在M点时,n(OH-)-n(H+)=a-0.05
C.a<0.001mol
D.当n(NaOH)=0.001mol时,c(H+)+c(CH3COOH)=2c(OH-)+c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是( )
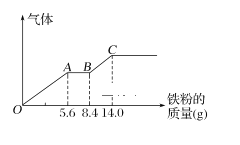
A. 原混合酸中NO3-物质的量为0.1 mol
B. OA段产生的气体是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生H2
C. 第二份溶液中最终溶质为FeSO4
D. H2SO4浓度为2.5 molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是一种重要的有机化工原料,其结构简式为![]() ,它一般不可能具有的性质是( )
,它一般不可能具有的性质是( )
A. 易溶于水,常温下为液体
B. 在空气中燃烧产生黑烟
C. 它能使溴的四氯化碳溶液褪色,也能使酸性高锰酸钾溶液褪色
D. 能发生加成反应,在一定条件下可与4倍物质的量的氢气加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是来自石油的重要有机化工原料,E是具果香味的有机物,F是一种高聚物,可制成多种包装材料。
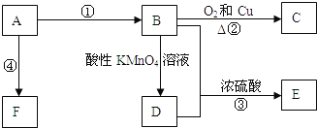
(1)A的电子式为:____________,C的名称:_____________,E的名称:____________ F的结构简式:________________。
(2)D分子中的官能团名称是____________,请设计一种实验来验证D物质存在该官能团的方法是_________________________________________。
(3)写出下列反应的化学方程式并指出反应类型:___________,反应类型_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中有丰富的资源,多种多样的海洋动物和植物,海底有丰富的矿藏、石油、天然气等,此外,海水中还含有大量的电解质,它们电离产生Cl-、Br-、I-、SO42-、Na+、Mg2+、Ca2+等,都是重要资源.开发和利用海水资源是当前科学研究的一项重要任务,如图是某化工厂对海水资源综合利用的示意图:
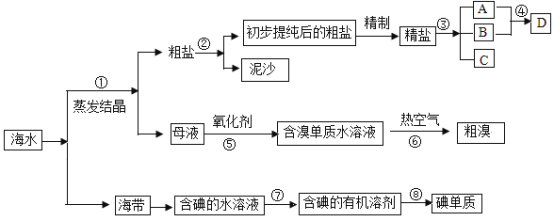
请根据以上信息回答下列问题:
(1)写出步骤②、⑧分离提纯的方法:
②_______⑧_______。
(2)步骤⑦分离提纯过程中需要选用的玻璃仪器除烧杯外,还需要的仪器是_____。
(3)D具有杀菌消毒的作用,请写出反应④的化学方程式_________________。
(4)初步提纯后的粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
①盐酸 ②氯化钡溶液 ③氢氧化钠溶液 ④碳酸钠溶液,
下列试剂添加顺序合理的是_________。
A.②③④① B.③④②① C.④③②① D.③②④①
(5)若用来提取Br2,反应⑤所用的氧化剂的来源较合理的是___________。
A.从外地购买 B.在当地新建生产厂 C.从本厂生产烧碱处循环
(6)流程⑥将溴单质从水溶液中分离出来是基于溴单质具有_______性,该方法对比有机溶剂萃取法的优点是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铝铁(PAFS)是一种高效净水剂,其组成表示为[AlFe(OH)x(SO4)(3-![]() )]y。为检测PAFS中Al的含量,设计如下流程。
)]y。为检测PAFS中Al的含量,设计如下流程。

回答下列问题:
(1)实验中需配制1.0mol/L的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为__。
(2)PAFS中铁元素的化合价为_______;沉淀A的化学式为_________。
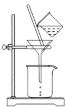
(3)如图所示,过滤操作中的一处错误是__________。
(4)生成沉淀B的离子方程式为______。
(5)PAFS中Al元素的质量分数为_______(用同m、n的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com