
【题目】“低碳经济”正成为科学家研究的主要课题,为了减少空气中的温室气体,并且充分利用二氧化碳资源,科学家们设想了一系列捕捉和封存二氧化碳的方法。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ΔH=-76.0 kJ·mol-1
①上述反应中每生成1 mol Fe3O4,转移电子的物质的量为_______mol。
②已知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H=+113.4kJ·mol-1,则反应:3FeO(s)+ H2O(g)= Fe3O4(s)+ H2(g)的△H=__________。
(2)用氨水捕集烟气中的CO2生成铵盐是减少CO2排放的可行措施之一。
①分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图所示,若烟气中CO2的含量(体积分数)为12%,烟气通入氨水的流量为0.052 m3·h-1(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量最多为____________(精确到0.01)。

②通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是______________。
(3)一定条件下,Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图所示。

①该反应的化学方程式为______________________;反应过程中碳元素的化合价为-2价的中间体是_________________。
②向一容积为2 L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2 mol·L-1、H2:0.8 mol·L-1、CH4:0.8 mol·L-1、H2O:1.6 mol·L-1,CO2的平衡转化率为_________________;300℃时上述反应的平衡常数K=___________________。
③已知该反应正反应放热,现有两个相同的恒容绝热(与外界无热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1molCO2和4molH2,在Ⅱ中充入1molCH4和2molH2O(g),300℃下开始反应。达到平衡时,下列说法正确的是___________________(填字母)。
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅱ中CH4的物质的量分数相同
C.容器Ⅰ中CO2的物质的量比容器Ⅱ中的多
D.容器Ⅰ中CO2的转化率与容器Ⅱ中CH4的转化率之和小于1
【答案】 2 +18.7kJ·mol-1 0.13mol 碳酸氢铵受热分解生成二氧化碳,氨水受热挥发 CO2+4H2![]() CH4+2H2O MgOCH2 80% 25 CD
CH4+2H2O MgOCH2 80% 25 CD
【解析】(1)考查得失电子的计算、热化学反应方程式的计算,①根据反应方程式,只有CO2中C的化合价降低,生成1molFe3O4时消耗0.5molCO2,即转移电子物质的量为0.5×4mol=2mol;②6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ①,C(s)+2H2O(g)=CO2(g)+2H2(g) ②,(①+②)/2,得出△H=(-76.0+113.4)/2kJ·mol-1=+18.7kJ·mol-1;(2)考查化学计算、化学反应控制条件,①pH=12.81,此时的CO2脱除效率为91.6%,脱除CO2的物质的量最多为 mol=0.13mol;②氨水受热易挥发,温度过高,造成氨水挥发,吸收CO2的量减少,CO2与NH3反应后生成NH4HCO3,NH4HCO3受热分解,造成CO2脱除效率降低;(3)考查化学平衡的计算、勒夏特列原理,①根据反应机理,整个过程中加入物质是CO2和H2,生成的是CH4和H2O,因此反应方程式为CO2+4H2
mol=0.13mol;②氨水受热易挥发,温度过高,造成氨水挥发,吸收CO2的量减少,CO2与NH3反应后生成NH4HCO3,NH4HCO3受热分解,造成CO2脱除效率降低;(3)考查化学平衡的计算、勒夏特列原理,①根据反应机理,整个过程中加入物质是CO2和H2,生成的是CH4和H2O,因此反应方程式为CO2+4H2![]() CH4+2H2O;Mg为+2价,H为+1价,O为-2价,因此表现-2价的中间体为MgOCH2;② CO2+4H2
CH4+2H2O;Mg为+2价,H为+1价,O为-2价,因此表现-2价的中间体为MgOCH2;② CO2+4H2![]() CH4+2H2O
CH4+2H2O
平衡: 0.2 0.8 0.8 1.6
变化:0.8 3.2 0.8 1.6
起始:1 4 0 0,CO2的转化率为0.8/1×100%=80%;根据平衡常数的定义,K= =25;③A、正反应是放热反应,反应I是向正反应方向进行,温度升高,化学速率快,反应II是向逆反应方向进行,向吸热反应方向进行,温度降低,化学反应速率变缓,故A错误;B、反应I向正反应方向进行,温度升高,容器为恒容绝热,对向正反应方向进行起到抑制,因此两个容器中CH4的质量分数不同,故B错误;C、根据B选项分析,故C正确;D、如果容器是恒温恒容,则CO2的转化率与反应II中CH4的转化率之和为1,因为是恒容绝热容器,转化率都要降低,因此两者转化率的和小于1,故D正确。
=25;③A、正反应是放热反应,反应I是向正反应方向进行,温度升高,化学速率快,反应II是向逆反应方向进行,向吸热反应方向进行,温度降低,化学反应速率变缓,故A错误;B、反应I向正反应方向进行,温度升高,容器为恒容绝热,对向正反应方向进行起到抑制,因此两个容器中CH4的质量分数不同,故B错误;C、根据B选项分析,故C正确;D、如果容器是恒温恒容,则CO2的转化率与反应II中CH4的转化率之和为1,因为是恒容绝热容器,转化率都要降低,因此两者转化率的和小于1,故D正确。
点睛:本题的难点是(3)③,学生没有注意到容器是恒容绝热,造成错选,绝热是容器与外界无热量的交换,像A选项,容器I正反应是放热反应,向正反应方向进行,温度升高,化学反应速率增大,容器II,是向逆反应方向进行,是向吸热反应方向进行,温度降低,化学反应速率变缓,因此平时做题时,读题要找到重点。
【题型】综合题
【结束】
11
【题目】氢能作为理想的清洁能源之一,已经受到世界各国的普遍关注。氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢方法有:配位氢化物储氢、碳质材料储氢、合金储氢、多孔材料储氢等。
请回答下列问题:
(1)氨硼烷( NH3BH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3制得。
①B、C、N、O第一电离能由大到小的顺序为_____________,CH4、H2O、CO2键角由大到小的顺序为_________________。
②1个(HB=NH)3分子中有______个σ键。与(HB=NH)3互为等电子体的分子为________(填分子式)。
③反应前后碳原子的杂化轨道类型分别为__________、____________。
④氨硼烷在高温下释放氢后生成的立方氮化硼晶体具有类似金刚石的结构,但熔点比金刚石低,原因是___________________________。
(2)一种储氢合金由镍和镧(La)组成,其晶胞结构如图所示。

①Ni 的基态原子核外电子排布式为_______________。
②该晶体的化学式为_______________。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=m pm,c=n pm;标准状况下氢气的密度为ρg·cm-3;阿伏加德罗常数的值为NA。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为______________。 (储氢能力=![]() )
)
【答案】 N>O>C>B CO2>CH4>H2O 12 C6H6 sp3 sp B—N键的键长大于C—C键的,键能小于C—C键的(指出键长或键能关系均给分) 1s22s22p63s23p63d84s2或[Ar]3d84s2 LaNi5 ![]() (或
(或 )
)
【解析】(1)考查第一电离能的规律、键角的大小、化学键数目的判断、杂化类型的判断,晶体熔沸点高低的判断,①同周期从左向右第一电离能增大,但IIA>IIIA,VA>VIA,因此第一电离能大小顺序是N>O>C>B;CH4的键角是109°28′,H2O的键角是105°,CO2的键角是180°,顺序是CO2>CH4>H2O;②成键原子间只能形成一个σ键,(HB=NH)3为六元环状化合物,因此1个(HB=NH)3中含有σ键个数为12个;根据等电子体的概念以及(HB=NH)3为六元环状化合物,推出等电子体的分子为C6H6;③反应前C为sp3杂化,反应后碳原子为sp杂化;③立方氮化硼晶体具有类似金刚石的结构,即立方氮化硼晶体为原子晶体,比较原子晶体熔沸点通过键长、键能考虑,B—N键的键长大于C—C键的,键能小于C—C键,因此立方氮化硼的熔沸点低于金刚石;(2)考查电子排布式、晶胞的计算,①Ni位于第四周期VIII族,28号元素,Ni的核外电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2;②La位于顶点,个数为8×1/8=1,Ni位于面上和体心,个数为8×1/2+1=5,化学式为LaNi5;③氢气的质量为![]() g,晶胞的体积为(m×10-10×m×10-10×n×10-10×sin60°)cm3,则储氢后氢气的密度为
g,晶胞的体积为(m×10-10×m×10-10×n×10-10×sin60°)cm3,则储氢后氢气的密度为 g/cm3,因此储氢材料故的储氢能力为
g/cm3,因此储氢材料故的储氢能力为![]() (或
(或 )。
)。


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】目前流行的H5N1型禽流感病毒核酸中含有A、U、G、C四种碱基,这说明该病毒的遗传物质是( )
A. DNA B. RNA C. DNA和RNA D. DNA或RNA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明的强酸性溶液中,能大量共存的是( )
A.Na+、NO3-、Cl-、Fe2+
B.K+、CO32-、Ca2+、NO3-
C.K+、SO42-、Al3+、Cl-
D.Ca2+、Cl-、K+、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科大陈乾旺教授等人发明RTX﹣r合成金刚石的新方法,化学原理为: ①Na+CO2 ![]() C(金刚石)+C(石墨)+Na2CO3(未配平);
C(金刚石)+C(石墨)+Na2CO3(未配平);
该方法比1955年人工首次制得金刚石的旧方法容易得多,其化学原理是:
②C(石墨) ![]() C(金刚石)
C(金刚石)
以下表述中正确的是( )
A.反应①中既有旧化学键的断裂又有新化学键的形成
B.新方法利用的是化学变化,旧方法利用的是物理变化
C.在反应①中每生成12g金刚石需要消耗23g金属钠
D.反应①和反应②中所得的金刚石都是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图与对应的反应情况正确的是( )

A. 向AgNO3和CuCl2的混合溶液中缓慢通入氨水溶液
B. 向NaOH和Ca(OH)2的混合溶液中通入CO2
C. KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液
D. NaAlO2、Na2CO3溶液中逐滴加入盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能作为理想的清洁能源之一,已经受到世界各国的普遍关注。氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢方法有:配位氢化物储氢、碳质材料储氢、合金储氢、多孔材料储氢等。
请回答下列问题:
(1)氨硼烷( NH3BH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3制得。
①B、C、N、O第一电离能由大到小的顺序为_____________,CH4、H2O、CO2键角由大到小的顺序为_________________。
②1个(HB=NH)3分子中有______个σ键。与(HB=NH)3互为等电子体的分子为________(填分子式)。
③反应前后碳原子的杂化轨道类型分别为__________、____________。
④氨硼烷在高温下释放氢后生成的立方氮化硼晶体具有类似金刚石的结构,但熔点比金刚石低,原因是___________________________。
(2)一种储氢合金由镍和镧(La)组成,其晶胞结构如图所示。

①Ni 的基态原子核外电子排布式为_______________。
②该晶体的化学式为_______________。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=m pm,c=n pm;标准状况下氢气的密度为ρg·cm-3;阿伏加德罗常数的值为NA。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为______________。 (储氢能力=![]() )
)
【答案】 N>O>C>B CO2>CH4>H2O 12 C6H6 sp3 sp B—N键的键长大于C—C键的,键能小于C—C键的(指出键长或键能关系均给分) 1s22s22p63s23p63d84s2或[Ar]3d84s2 LaNi5 ![]() (或
(或 )
)
【解析】(1)考查第一电离能的规律、键角的大小、化学键数目的判断、杂化类型的判断,晶体熔沸点高低的判断,①同周期从左向右第一电离能增大,但IIA>IIIA,VA>VIA,因此第一电离能大小顺序是N>O>C>B;CH4的键角是109°28′,H2O的键角是105°,CO2的键角是180°,顺序是CO2>CH4>H2O;②成键原子间只能形成一个σ键,(HB=NH)3为六元环状化合物,因此1个(HB=NH)3中含有σ键个数为12个;根据等电子体的概念以及(HB=NH)3为六元环状化合物,推出等电子体的分子为C6H6;③反应前C为sp3杂化,反应后碳原子为sp杂化;③立方氮化硼晶体具有类似金刚石的结构,即立方氮化硼晶体为原子晶体,比较原子晶体熔沸点通过键长、键能考虑,B—N键的键长大于C—C键的,键能小于C—C键,因此立方氮化硼的熔沸点低于金刚石;(2)考查电子排布式、晶胞的计算,①Ni位于第四周期VIII族,28号元素,Ni的核外电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2;②La位于顶点,个数为8×1/8=1,Ni位于面上和体心,个数为8×1/2+1=5,化学式为LaNi5;③氢气的质量为![]() g,晶胞的体积为(m×10-10×m×10-10×n×10-10×sin60°)cm3,则储氢后氢气的密度为
g,晶胞的体积为(m×10-10×m×10-10×n×10-10×sin60°)cm3,则储氢后氢气的密度为 g/cm3,因此储氢材料故的储氢能力为
g/cm3,因此储氢材料故的储氢能力为![]() (或
(或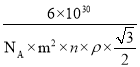 )。
)。
点睛:本题的难点是储氢能力的计算,虽然题目中告诉学生储氢能力计算的公式,但学生对储氢后氢气的密度理解不透,无法进行计算,其实储氢后氢气的密度就是让求出晶胞中氢气的质量,与晶胞体积的比值,跟平时练习晶胞密度的计算是一样的,只不过本题求的质量是氢气的质量。
【题型】综合题
【结束】
12
【题目】G是一种新型香料的主成分之一,其结构中含有三个六元环。G 的合成路线如下图所示(部分产物和反应条件已略去)。

已知:①RCH=CH2+CH2=CHR'![]() CH2=CH2+RCH=CHR';
CH2=CH2+RCH=CHR';
②B的核磁共振氢谱图显示分子中有6种不同环境的氢原子;
③D和F是同系物。
请回答下列问题:
(1)根据系统命名法,(CH3)2C=CH2的名称为_____________。
(2)A→B反应过程中涉及的反应类型分别为_______________、_________________。
(3)生成E的化学方程式为______________________________。
(4)G的结构简式为_________________。
(5)写出一种同时满足下列条件的F的同分异构体的结构简式:_________________。
①与FeCl3溶液发生显色反应;②苯环上有两个取代基,含C=O键;③能发生水解反应;④核磁共振氢谱有4组峰。
(6)模仿由苯乙烯合成F的方法,写出由丙烯制取a-羟基丙酸(![]() ) 的合成路线:____________________________。
) 的合成路线:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 A + 3B![]() 2C + 2D 在四种不同条件下的反应速率为: (1)v(A)=0.03mol/(L·s) (2)v(B)=3.6mol/(L·min) (3)v(C)=0.04mol/(L·s) (4)v(D)=2.7mol/(L·min),则该反应速率的快慢顺序为 ( )
2C + 2D 在四种不同条件下的反应速率为: (1)v(A)=0.03mol/(L·s) (2)v(B)=3.6mol/(L·min) (3)v(C)=0.04mol/(L·s) (4)v(D)=2.7mol/(L·min),则该反应速率的快慢顺序为 ( )
A. (2)>(4)>(3)>(1) B. (1)>(4)>(2)= (3)
C. (4)>(3)=(2)>(1) D. (2)>(3)= (4)>(1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列几个装置示意图,有关叙述正确的是( ) 
A.装置①中阳极上析出红色固体
B.装置②的待镀铁制品应与电源正极相连
C.装置③中外电路电子由a极流向b极
D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中均为微量元素的是 ( )
A. Fe Mn Zn Mg B. Zn Cu Mn Ca
C. Zn Cu B Fe D. Mg Mn Cu Mo
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com