
【题目】实验测得,某有机物相对分子质量为72。
(1)若该有机物是烃,其分子式为__________。它有______种同分异构体。若该烃与![]() 发生取代反应,生成的一氯代物只有1种,则该烃的结构简式为___________________。
发生取代反应,生成的一氯代物只有1种,则该烃的结构简式为___________________。
(2)若该有机物分子中只有一个氧原子,其分子式为_____________________。
(3)若该有机物![]() 完全燃烧生成0.15molCO2和0.1molH2O,则该有机物的分子式为___________。
完全燃烧生成0.15molCO2和0.1molH2O,则该有机物的分子式为___________。
【答案】C5H12 3 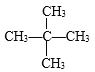 C4H8O C3H4O2
C4H8O C3H4O2
【解析】
(1)用商余法计算确定物质的分子式,然后根据烃的类别判断其同分异构体数目,若该烃与Cl2发生取代反应,生成的一氯代物只有1种,说明该烃分子中只有一种位置的H原子;
(2)O原子相对原子质量是16,用相对分子质量与O原子相对原子质量的差除12,得到的商为C原子数,余数为H原子数,从而可得物质的分子式;
(3)3.6g有机物中O元素质量为3.6g-0.15mol×12g/mol-0.1mol×2×1g/mol=1.6g,则氧原子物质的量为n(O)=![]() =0.1mol,则分子中C、H、O原子数目之比为0.15:0.2:0.1=3:4:2,最简式为C3H4O2,其相对分子质量为72,因此该物质的分子式为C3H4O2。
=0.1mol,则分子中C、H、O原子数目之比为0.15:0.2:0.1=3:4:2,最简式为C3H4O2,其相对分子质量为72,因此该物质的分子式为C3H4O2。
(1)相对分子质量为72的某烃,其中含有的C原子数可能:72÷12=5……12,因此可确定该物质分子为C5H12;其可能的同分异构体有CH3CH2CH2CH2CH3、![]() 、
、 三种结构;若该烃与Cl2发生取代反应,生成的一氯代物只有1种,说明该烃分子中只有一种位置的H原子,该物质结构为
三种结构;若该烃与Cl2发生取代反应,生成的一氯代物只有1种,说明该烃分子中只有一种位置的H原子,该物质结构为 ;
;
(2)若该有机物分子中只含有1个O原子,则其中含有的C、H两种元素的相对原子质量的和为72-16=56,含有的56÷12=4……8,说明分子中含4个C原子,8个H原子,因此该物质分子式为C4H8O;
(3)3.6g有机物中O元素质量为3.6g-0.15mol×12g/mol-0.1mol×2×1g/mol=1.6g,则氧原子物质的量为n(O)=![]() =0.1mol,则分子中C、H、O原子数目之比为0.15:0.2:0.1=3:4:2,最简式为C3H4O2,其相对分子质量为72,因此该物质的分子式为C3H4O2。
=0.1mol,则分子中C、H、O原子数目之比为0.15:0.2:0.1=3:4:2,最简式为C3H4O2,其相对分子质量为72,因此该物质的分子式为C3H4O2。


科目:高中化学 来源: 题型:
【题目】将乙烯分别通过如图所示的装置,下列叙述正确的是( )

A. 二者都褪色且原理相同
B. 二者都能证明乙烯中有碳碳双键
C. 二者都可用于除去乙烷中混有的乙烯
D. 二者都可用于鉴别乙烷和乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:烃的衍生物A的摩尔质量为32 g·molˉ1,且能与金属钠反应。E的分子式为C3H6O2。有关物质的转化关系如下:
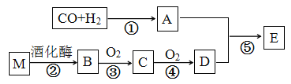
请回答:
(1)D中含有的官能团名称是____________,反应⑤的反应类型为_________。
(2)写出烃的衍生物A与金属钠反应的化学方程式__________________________。
(3)写出反应②的化学方程式____________。写出反应③的化学方程式______________。
(4)写出有机物E与NaOH溶液反应的化学方程式_______________________。
(5)下列说法正确的是________。
A.有机物C的水溶液常用于标本的防腐
B.有机物B、D都能与金属钠发生反应
C.有机物E中混有D,可用饱和碳酸钠溶液进行分离
D.有机物M为高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属吸热反应的是( )
A. Zn与稀硫酸反应放出氢气 B. 酸碱中和反应
C. 硫在空气或氧气中燃烧 D. Ba(OH)2·8H2O与NH4Cl反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“乙醇催化氧化”的实验装置如图所示:
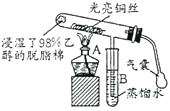
实验操作为:预先使棉花团浸透乙醇,并照图安装好仪器,在铜丝的中间部位加热片刻后,用气囊有节奏地鼓入空气,即可观察到以下明显的实验现象。
请回答以下问题:
(1)在实验过程中铜丝出现红色和黑色交替的现象,说明在该实验过程中催化剂_________![]() 填“参与了”或“没有参与”
填“参与了”或“没有参与”![]() 化学反应;写出乙醇催化氧化反应的化学方程式_________。
化学反应;写出乙醇催化氧化反应的化学方程式_________。
(2)在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明乙醇催化氧化反应是____反应。
(3)B中用蒸馏水收集到的物质可能有__________![]() 填物质的名称
填物质的名称![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】球墨铸铁中含有一种铁碳化合物X。实验室测定化合物X的组成实验如下:
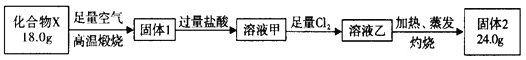
下列说法不正确的是
A. 固体2是氧化铁 B. X的化学式可以表示为Fe3C2
C. 溶液甲中可能含有Fe3+ D. X与足量的热浓硝酸反应有NO2和CO2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分NaClO)。一化学小组在室温下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO3-等离子的物质的量(mol)与反应时间t(min)的关系曲线。下列说法不正确的是
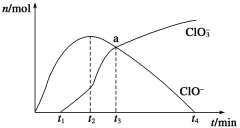
A. 工业制取漂白液的化学反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O
B. a点时溶液中各离子浓度:c(Na+)>c(Cl-)>c(ClO3-)=c(ClO-)>c(OH-)>c(H+)
C. t2~t4,ClO-离子的物质的量下降的原因可能是3ClO-= 2Cl-+ClO3-
D. 使用漂白液时,为了增强漂白效果,可以向漂白液中加入浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴甲基橙指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中用蒸馏水溶解
D.将物质的量浓度为c的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是________ →________ →________ →D→________(均用字母填写)。
(2)滴定管的读数应注意_________________________________。
(3)E中在锥形瓶下垫一张白纸的作用是____________________。
(4)D步骤中液面应调节到____________________,尖嘴部分应__________________。
(5)滴定终点时锥形瓶内溶液的pH约为________,终点时颜色变化是_____________________________________________________。
(6)若酸式滴定管不用标准硫酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?________(填“偏高”“偏低”或“不变”)。
(7)该烧碱样品纯度的计算式为___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com