
| A. | 某“焰色反应”的焰色结果为黄色,则样品中一定含“Na”元素,未必不含“K”元素 | |
| B. | 做“焰色反应”实验时,如果没有铂丝,可用铁丝代替 | |
| C. | “焰色”是金属单质或其离子燃烧时体现出来的火焰颜色 | |
| D. | 做“焰色反应“实验时,用于清洗铂丝的酸宜选用盐酸,不宜选用硫酸 |
分析 A.K元素的紫光能被黄光掩盖;
B.洁净无色的铁丝在火焰上灼烧时也无特殊颜色;
C.焰色反应是一种元素的性质;
D.盐酸易挥发,硫酸不挥发.
解答 解:A.物质灼烧时,焰色反应为黄色,说明该物质中一定含有Na元素,由于K元素的紫光能被黄光掩盖,可能含有钾元素,故A正确;
B.铁丝灼烧时无焰色,故可用洁净无锈的铁丝代替铂丝进行焰色反应实验,故B正确;
C.焰色反应是元素的性质,金属单质或其化合物等在灼烧时都可以产生相同的焰色,故C错误;
D.硫酸难挥发,清洗做焰色反应的铂丝后有残留,应该用盐酸洗涤铂丝,故D正确;
故选C.
点评 本题主要考查了焰色反应,难度不大,需要注意的是焰色反应是物理变化,表现的是某一种金属元素的性质.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②③ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
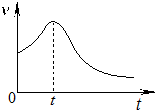 污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.
污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.| 实验序号 | 温度/℃ | 各物质的体积/mL | 反应时间 | |||
| H2O | 3mol/L稀硫酸 | 0.1mol/L KMnO4溶液 | 0.6mol/LH2C2O4溶液 | |||
| 1 | 25 | 3.0 | 2.0 | 4.0 | 6.0 | t1 |
| 2 | ① | 5.0 | 2.0 | 4.0 | 4.0 | t2 |
| 3 | 25 | ② | 2.0 | 4.0 | 2.0 | t3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有含有少量KCl、K2SO4、K2CO3杂质的KNO3溶液,选择适当的试剂除去杂质,得到纯净的KNO3固体,实验流程如图所示.
现有含有少量KCl、K2SO4、K2CO3杂质的KNO3溶液,选择适当的试剂除去杂质,得到纯净的KNO3固体,实验流程如图所示.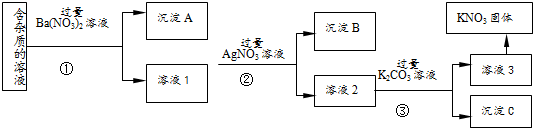
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸馏法可实现海水的淡化 | |
| B. | 乙醇可以用作“提取碘水中的碘”的萃取剂 | |
| C. | 用“蒸发结晶”的方法从氯化钠溶液中分离得到氯化钠晶体 | |
| D. | 除去氧化铁中的氧化铝杂质:用NaOH溶液浸泡,再过滤、洗涤、干燥,即可得到纯净氧化铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

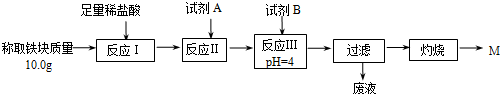
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
| 操作 | 预期现象 |
| 取少量M固体于试管中,向其中加入足量稀硫酸;观察. | 固体完全溶解,溶液呈黄色. |
继续向上述溶液中滴入几滴(少量)高锰酸钾溶液,振荡观察 | 溶液紫红色未褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
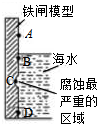 铁及其化合物与生产、生活关系密切,
铁及其化合物与生产、生活关系密切,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤⑥⑦ | B. | ①③④⑤ | C. | ①②③④⑤⑦ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com