
| A. | HCl | B. | Na2O | C. | NaCl | D. | NaOH |
科目:高中化学 来源: 题型:选择题
| A. | 在相同的条件下,2mol 氢气与 1 mol 氧气的总能量小于2mol 水蒸气的总能量 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)→H2O(1)+Q1;Q1>241.8kJ | |
| C. | H2(g)+$\frac{1}{2}$O2(g)→H2O(1)+Q2;Q2<241.8kJ | |
| D. | 任何条件下,2L水蒸气分解成2L氢气与1L氧气需吸收483.6kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水溶解氯化银沉淀:AgCl+2NH3•H2O=[Ag(NH3)2]+Cl-+2H2O | |
| B. | 向Na2S2O3溶液中通入足量氯水:S2O32-+2Cl2+3H2O═2SO32-+4Cl-+6H+ | |
| C. | 酸性K2Cr2O7溶液氧化双氧水:Cr2O72-+8H++5H2O2=2Cr3++4O2↑+9H2O | |
| D. | 1.0mol/L的NaAlO2溶液和2.5mol/L盐酸等体积混合:AlO2-+4H+=5Al3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑧ | B. | ④⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | 氨气 | 硫酸 | 小苏打 | 氧化钙 | 干冰 |
| B | 烧碱 | 盐酸 | 食盐 | 氧化钠 | 一氧化碳 |
| C | 石灰水 | 冰醋酸CH3COOH | 胆矾 CuSO4•5H2O | 过氧化钠 | 二氧化硫 |
| D | NH3•H2O | HNO3 | 碳酸钙 | 氧化铁 | SO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO42- NaHCO3在水中的电离方程式为:NaHCO3=Na++H++CO32- | |
| B. | NaCl溶液能导电是因为溶液中有能自由移动的Na+和Cl- | |
| C. | 液态氯化氢和稀盐酸一样可以导电 | |
| D. | 向某溶液中加入BaCl2溶液,产生白色沉淀,再加入盐酸,沉淀不消失,则原溶液中一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
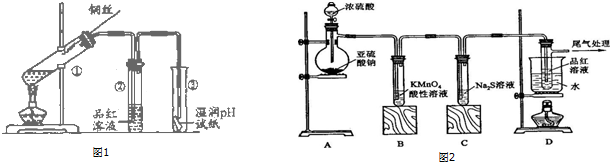
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com