
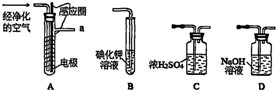
分析 (1)O2在无碳、无水的环境下制备臭氧,所以空气中的水和二氧化碳要先除去;
(2)O3将碘化钾氧化成碘,据此判断碘化钾溶液的颜色变化;
(3)①萃取实验中要用分液漏斗;
②根据关系式I2~03~$\frac{3}{2}$O2,可计算出转化了的氧气的物质的量,根据转化率=$\frac{消耗量}{起始量}$×100%计算;
③在放电条件下,空气中的氧气有可能与氮气产生氮的氧化物,这些氮的氧化物能氧化碘化钾,所以要除去;
(4)由于03和02的沸点不同,所以可将混合气体液化后再分馏的方法进行分离;
(5)OCN一继续转化为CO32一及两种单质气体,这两种单质应为氮气和氧气,当O3与OCN-物质的质量之比为3:2时,根据电荷守恒可写出离子方程式.
解答 解:(1)O2在无碳、无水的环境下制备臭氧,空气中的水和二氧化碳要先除去,所以空气通入A装置之前,应先后通过上述装置中的D和C,
故答案为:D;C;
(2)O3将碘化钾氧化成碘,无色的碘化钾溶液会出现紫红色,
故答案为:溶液出现紫红色;
(3)①萃取实验中要用分液漏斗,
故答案为:分液漏斗;
②当I2固体0.254g即0.001mol时,根据关系式I2~03~$\frac{3}{2}$O2,可知参加反应的氧气的物质的量为0.0015mol,实验时通入空气1.12L即0.05mol,其中氧气的物质的量为0.01mol,所以O2的转化率为 $\frac{0.0015mol}{0.01mol}$×100%=15%,
故答案为:15%;
③在放电条件下,空气中的氧气有可能与氮气产生氮的氧化物,这些氮的氧化物能氧化碘化钾,所以测定时需在A,B装置间连接装置D,
故答案为:除去臭氧中的氮的氧化物;
(4)由于03和02的沸点不同,所以可将混合气体液化后再分馏的方法进行分离,故选B,
故答案为:B;
(5)OCN-继续转化为CO32-及两种单质气体,这两种单质应为氮气和氧气,当O3与OCN-物质的质量之比为3:2时,反应的离子方程式为:2OH-+3O3+2OCN-=2CO32-+N2+3O2+H2O,
故答案为:2OH-+3O3+2OCN-=2CO32-+N2+3O2+H2O.
点评 本题主要考查了物质的制备,除杂和提纯,题目难度中等,注意利用题目信息分析问题,培养了学生解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 导电性好 | B. | 不易生锈 | C. | 光泽度好 | D. | 强度高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中含有2mol K2SO4 | B. | 可将2mol K2SO4溶于1L水中制得 | ||
| C. | 溶液中c(K+ )=4 mol•L-1 | D. | 1L 溶液中含4molK+,4molSO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.9kJ/mol | B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-241.8kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=+285.9kJ/mol | D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=+241.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
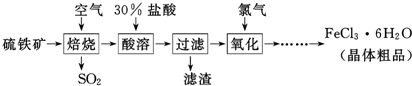
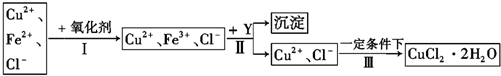
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 假 设 | 操 作 | 现 象 | 原 理 |
| Na2S2O4为强碱弱酸盐,其溶液为碱性. | 取少量溶液于试管中,滴加 ②紫色石蕊试液 | 溶液变成蓝色 | S2O42-水解,使溶液成碱性 |
| ①Na2S2O4具有还原性 | 取少量溶液于试管中,滴加过量新制氯水,再滴加 BaCl2 溶液 | 有白色沉淀生成 | 该反应的离子方程式依次为:③4H2O+S2O42-+3Cl2=2SO42-+6Cl-+8H+,④Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
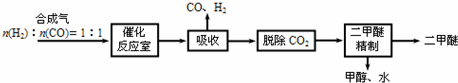
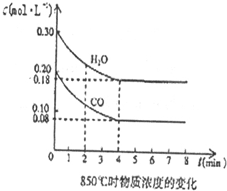
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com