
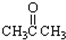 ③CH3CH2Br④
③CH3CH2Br④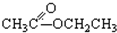 ⑤
⑤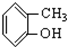 ⑥
⑥ ⑦
⑦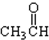 ⑧
⑧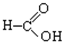 ⑨
⑨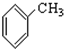 (10))
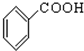
(10))
分析 (1)属于芳香烃的有机物只含C、H两种元素,且含有苯环或稠环;
(2)属于醇类的物质应含有羟基,且羟基与苯环不直接相连;
(3)根据醛基的结构简式判断;
(4)属于羧酸的有机物应含有-COOH.
解答 解:(1)属于芳香烃的有机物只含C、H两种元素,且含有苯环或稠环,题中只有⑨符合,故答案为:⑨;
(2)属于醇类的物质应含有羟基,且羟基与苯环不直接相连,题中只有①符合,故答案为:①;
(3)醛基的结构简式为 ,则题中⑦⑧含有醛基,故答案为:⑦⑧;
,则题中⑦⑧含有醛基,故答案为:⑦⑧;
(4)羧基的结构简式为-COOH,则题中⑧⑩为羧酸,故答案为:⑧⑩.
点评 本题考查官能团的结构和性质,侧重于有机物化合物基础知识的考查,注意把握有机物的官能团的结构简式和有机物类别的判断,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提高反应物的利用率 | B. | 改变平衡混合物的组成 | ||
| C. | 以同样程度改变正逆反应的速率 | D. | 增大正反应速率,减小逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油和天然气的主要成分都是碳氢化合物 | |
| B. | 甲烷和乙烯都能与Cl2发生反应 | |
| C. | 乙烯可以合成有机高分子材料 | |
| D. | 苯和乙醇都能被酸性KMnO4溶液氧化而使KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
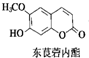 中草药中常存在东莨菪内酯,属于香豆素类化合物,东莨菪内酯结构如图所示.下列东莨菪内酯的说法正确的是( )
中草药中常存在东莨菪内酯,属于香豆素类化合物,东莨菪内酯结构如图所示.下列东莨菪内酯的说法正确的是( )| A. | 分子式为C10H12O4 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 一定条件下,1 mol该物质最多可与3 mol Br2反应 | |
| D. | 一定条件下,1 mol该物质最多可与1 mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
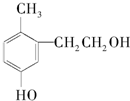
| A. | 该物质在加热条件下可以与铜反应生成一种具有醛基的化合物 | |
| B. | 1 mol该物质能与溴水反应消耗3 mol Br2发生取代反应 | |
| C. | 1 mol该有机物能与足量金属钠反应生成0.5 mol H2 | |
| D. | 1 mol该有机物能与2 mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com