
(12分).
在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应:
A(g) B(g)+C(g) △H=+85.1kJ·mol-1(吸热反应)
B(g)+C(g) △H=+85.1kJ·mol-1(吸热反应)
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
| 反应时间t/h | 0 | 4 | 8 | 16 |
| C(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.0065 |
(1)升高温度、降低压强
(2)α(A)="(" 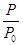 -1)100%;94.1%;
-1)100%;94.1%;
(3)①0.1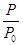 ;0.1(2-
;0.1(2-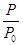 );
);
②0.051(1分);每间隔4小时,A的浓度为原来的一半。0.013(1分)
解析试题分析:(1) 欲提高A的平衡转化率即让此反应向正反应方向移动。此反应是吸热反应,升高温度,平衡向正方向移动;此反应是气体分子数增大的反应,降低压强,平衡向分子数减少的方向即正方向移动。
(2) 在相同条件下,压强之比等于物质的量之比。在此反应中 A(g) B(g)+C(g),P/P0=n/n0,n与n0分别为气体总物质的量和起始时气体的物质的量,在反应中增加的物质的量和反应的A的物质的量相等,所以A的转化率为(n-n0)/n0100%=" (P-" P0)/P0100%="("
B(g)+C(g),P/P0=n/n0,n与n0分别为气体总物质的量和起始时气体的物质的量,在反应中增加的物质的量和反应的A的物质的量相等,所以A的转化率为(n-n0)/n0100%=" (P-" P0)/P0100%="(" 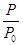 -1)100%;平衡时A的转化率为(9.53-4.91)/4.91
-1)100%;平衡时A的转化率为(9.53-4.91)/4.91
=94.1%。
①起始时在1.0 L密闭容器中放入0.10molA(g),n总 =" n(A)+" n(A)×α(A)=" n(A)×(1+α(A))=" 0.1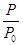 mol,n(A)= 0.1(2-
mol,n(A)= 0.1(2-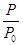 )mol。
)mol。
②对照反应时间和反应物A的浓度的关系即可得到。
考点:考查影响化学平衡的因素,转化率的计算。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:单选题
某温度下,在一容积可变的容器中,反应:2A(g)+B(g) 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是 ( )
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是 ( )
A.均减半 B.均加倍 C.均增加1 mol D.均减少1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)水煤气不仅是合成氨的原料气也是合成烃及其化工产品的原料。
(1)直接水煤气燃料电池中,通CO、H2的极为电池的 极(选填:“正”,“负”)。
(2)水煤气变换反应:CO(g) + H2O(g)  CO2(g) + H2(g) △H < 0,下列措施能提高反应速率的有 (不定项选择)。
CO2(g) + H2(g) △H < 0,下列措施能提高反应速率的有 (不定项选择)。
a.升高温度 b.加入催化剂 c.增大压强 d.降低浓度
(3)H2和N2在催化剂、高温高压条件下合成氨的化学方程式为 。
(4)氨气的水溶液可用于吸收烟道气中的二氧化硫,该反应的化学方程式为 。
(5)将标准状况下582.4L合成气(已知:n(CO)∶n(H2)=4∶9)通入合成塔,一定条件下可发生2CO(g)+ 4H2(g) → CH2=CH2(g)+2H2O(g);CO(g)+3H2→CH4(g)+H2O(g),充分反应后,经测定产品中只有甲烷、乙烯和水蒸气(假定CO和H2均无剩余),试计算逸出的气体中乙烯的物质的量(列出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)在一定温度下,体积为2 L的密闭容器中,NO2和N2O4之间发生反应:2NO2 (g) (红棕色) N2O4(g) (无色),如图所示。
N2O4(g) (无色),如图所示。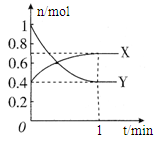
(1)曲线 (填“X”或“Y”)表示NO2的物质的量随时间的变化曲线。
(2)若升高温度,则v(正) ,v(逆) 。(填“加快”或“减慢”)。
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=18 mol/(L·min),乙中v(N2O4)=0.2 mol/(L·s),则 中反应更快。
(4)在0到1 min中内用X表示该反应的速率是 ,该反应达限度时,Y的转化率 ,反应开始时与反应达平衡状态时的压强之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入0.5 L密闭容器内,550℃时,在催化剂作用下发生反应: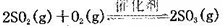 (正反应放热)。测得n(O2)随时间的变化如下表
(正反应放热)。测得n(O2)随时间的变化如下表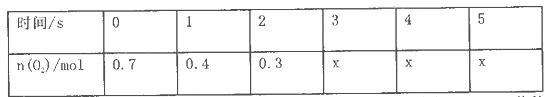
反应达到5s后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了22. 4L(此体积为标准状况下的体积);再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(此体积为标准状况下的体积)。
请回答下列问题:
(1)用O2表示从0-ls内该反应的平均反应速率为__________________。
(2)O2的平衡浓度c (O2)=____________________________;
(3) 4s时,SO2的生成速率____________(填“大于”、“小于”或“等于”)O2的消耗速率。
(4)求该反应达到平衡时SO2的转化率是________(用百分数表示)。
(5)若将平衡混台气体中SO3的5%通入过量的BaCl2溶液,生成沉淀_______克(计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)以下是一些物质的熔沸点数据(常压):
| | 钾 | 钠 | Na2CO3 | 金刚石 | 石墨 |
| 熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 774 | 882.9 | 1850(分解产生CO2) | --- | 4250 |
 2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol
2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(9分)硝基苯甲酸乙酯在OH-存在下发生水解反应:O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH.两种反应物的初始浓度均为0.050mol/L,15 ℃时测得:O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。回答下列问题:
O2NC6H4COO-+C2H5OH.两种反应物的初始浓度均为0.050mol/L,15 ℃时测得:O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。回答下列问题:
| t/s | 0 | 120 | 180 | 240 | 330 | 30 | 600 | 700 | 800 |
| α/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(7分)(1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则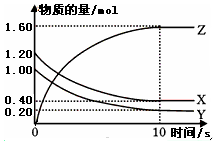
①此反应的化学方程式为________________;
②0~10s内,用Z表示的化学反应速率为________________;
③X的转化率为________________;
(2)恒温恒容时,某密闭容器中发生反应:C(s)+CO2(g) 2CO(g),下列描述中能说明该反应已达到化学平衡状态的是________________。
2CO(g),下列描述中能说明该反应已达到化学平衡状态的是________________。
①C(s)的浓度不再改变 ②CO2的体积分数不再改变
③气体的质量不再改变 ④气体的密度不再改变
⑤单位时间内消耗1molCO2,同时生成2molCO
⑥n(CO2):n(CO)=1:2 ⑦v正(CO2)=2v逆(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某校化学研究性学习小组学习了化学反应与能量的内容后,对CaCO3与稀盐酸的反应进行了相关探究。他们在室温条件下,将CaCO3块状固体放入1L、1mol?L-1稀盐酸中,记录下了随反应时间的变化生成CO2气体的物质的量情况,绘制成如图曲线。假设溶液的体积变化忽略不计,请分析以下问题: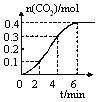
(1)若想加快该反应的速率,可以采取的措施是 、 (答两种)。
(2)0~2min内,用HCl浓度变化表示的平均反应速率为 ,比较0~2min、2~4min、4~6min三个时间段,反应速率最大的是 。
(3)根据定量的数据,定性的描述0~6min内该反应的化学反应速率的变化情况 ;呈现这种变化的原因是 。
(4)根据图像中曲线的变化趋势,第8min时,该反应的反应速率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com