
| 实验方案 | 预测实验现象 | 相应结论 | |
| A | 向酸性Fe(NO3)3溶液通入少量H2S | 有黄色沉淀 | Fe(NO3)3中铁元素具有氧化性 |
| B | CH3CH2Br与NaOH乙醇共热后将气体通入酸性高锰酸钾溶液 | 高锰酸钾溶液褪色 | CH3CH2Br与NaOH乙醇溶液共热生成乙烯 |
| C | 测定相同条件下等物质的量浓度的CH3COONa、NaHCO3的pH | NaHCO3溶液的pH大 | 酸性:碳酸<乙酸 |
| D | 10mL0.1mol/L的NaOH溶液滴入2mL等浓度的MgCl2溶液,然后再滴加FeCl3溶液 | 先出现白色沉淀,后沉淀变为红褐色 | Ksp[Fe(OH)3]<Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
分析 A.酸性条件下,硝酸根离子与H2S发生氧化还原反应;
B.乙醇易挥发,乙醇能被高锰酸钾氧化;
C.盐溶液的pH越大,对应弱酸的酸性越弱;
D.NaOH过量,均为沉淀的生成.
解答 解:A.酸性条件下,硝酸根离子与H2S发生氧化还原反应,则不能说明铁离子具有氧化性,故A错误;
B.乙醇易挥发,乙醇能被高锰酸钾氧化,则不能检验乙烯,故B错误;
C.盐溶液的pH越大,对应弱酸的酸性越弱,则酸性:碳酸<乙酸,故C正确;
D.NaOH过量,均为沉淀的生成,不能比较Ksp[Fe(OH)3]、Ksp[Mg(OH)2],故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握氧化还原反应、物质的检验、盐类水解、沉淀生成为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:选择题
| 化学键 | C-C | C-H | H-H | C-O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 463 |
| A. | 1550+43.2kJ•mol-1 | B. | 750-43.2kJ•mol-1 | ||
| C. | 1550+86.4kJ•mol-1 | D. | 750+43.2kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
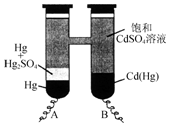 依据Cd(Hg)+Hg2SO4═3Hg+Cd2++SO42-反应原理,设计出韦斯顿标准电池,其简易装置如图.下列有关该电池的说法正确的是( )
依据Cd(Hg)+Hg2SO4═3Hg+Cd2++SO42-反应原理,设计出韦斯顿标准电池,其简易装置如图.下列有关该电池的说法正确的是( )| A. | 电池工作时Cd2+向电极B移动 | |
| B. | 电极A上发生的反应:Hg2SO4+2e-═2Hg+SO42- | |
| C. | 电极B上发生的反应:Cd(Hg)-4e-═Hg2++Cd2+ | |
| D. | 反应中每生成a mol Hg转移3a mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
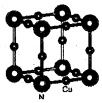 配合物[Cu(CH3C≡N)4]BF4是双烯合成反应的催化剂,它被浓硝酸分解的化学方程式为:[Cu(CH3C≡N)4]BF4$\stackrel{HNO_{3}}{→}$Cu2++H3BO3+CO2↑+HF…(未配平).
配合物[Cu(CH3C≡N)4]BF4是双烯合成反应的催化剂,它被浓硝酸分解的化学方程式为:[Cu(CH3C≡N)4]BF4$\stackrel{HNO_{3}}{→}$Cu2++H3BO3+CO2↑+HF…(未配平).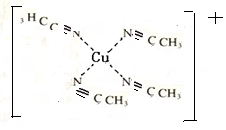 (不考虑空间构型).
(不考虑空间构型).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D与E可形成既含极性键又含非极性键的分子 | |
| B. | B的最高价氧化物为酸性氧化物,不能与任何酸反应 | |
| C. | B、C、E三种元素的最高价氧化物对应的水化物中,B的酸性最弱 | |
| D. | A、C、D中两种或三种元素形成的钠盐溶液可显酸性、中性或碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
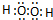 .
. ,用电子式表示A2C的形成过程.
,用电子式表示A2C的形成过程.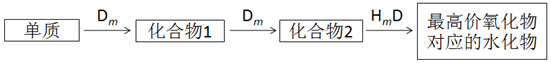
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化物都是碱性氧化物 | B. | 氢氧化物都是白色固体 | ||
| C. | 单质都可以与水反应 | D. | 单质在空气中都形成致密氧化膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
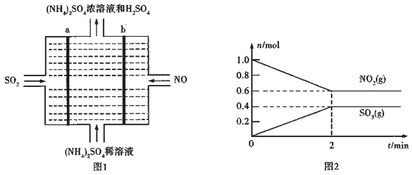
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com