
分析 (1)反应3FeS2+8O2=Fe3O4+6SO2中Fe元素化合价又+2→+3,化合价升高,S元素化合价由-1→+4,化合价升高,O元素化合价由0→-2,化合价降低;
(2)铁离子具有氧化性能氧化铜生成铜离子;
(3)Fe3+水解生成Fe(OH)3胶体可以净水;
(4)铁先与Fe3+反应,然后再与氢离子反应,结合反应的离子方程式计算;
(5)氯化铁具有氧化性碘化氢具有还原性,二者发生氧化还原反应生成氯化亚铁和碘单质;
解答 解:(1)反应3FeS2+8O2=Fe3O4+6SO2,前后各元素化合价的变化情况如下:
Fe:+2→+3,化合价升高;S:-1→+4,化合价升高;O:0→-2,化合价降低;
因此,在反应中FeS2还原剂,O2是氧化剂,Fe3O4既是氧化产物也是还原产物,SO2既是氧化产物也是还原产物;在上述反应中共转移32个电子,有3molFeS2参加反应,转移电子的物质的量为32mol.
故答案为:SO2和Fe3O4;32;
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(3)Fe3+水解生成Fe(OH)3胶体可以净水,Fe3++3H2O?Fe(OH)3+3H+,故答案为:Fe3++3H2O?Fe(OH)3+3H+;
(4)氢气的物质的量为 0.1mol,
由关系式Fe~~~~2HCl~~~H2,得到
0.1mol 0.2mol 0.1mol
根据氯原子守恒,所以氯化铁的物质的量为$\frac{1}{3}$×(0.16L×5mol/L-0.2mol)=0.2mol,
Fe~~~2FeCl3
0.1mol 0.2mol
所以参加反应的铁粉的质量为(0.1mol+0.1mol)×56g/mol=11.2g,
故答案为:11.2;
(5)氯化铁具有氧化性碘化氢具有还原性,二者发生氧化还原反应生成氯化亚铁和碘单质,反应的离子方程式为2Fe3++2I-=2Fe2++I2,故答案为:2Fe3++2I-=2Fe2++I2;
点评 本题综合考查氧化还原反应、元素化合物知识,为高频考点,侧重学生的分析、计算能力的考查,注意把握物质的性质,难度中等.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:解答题
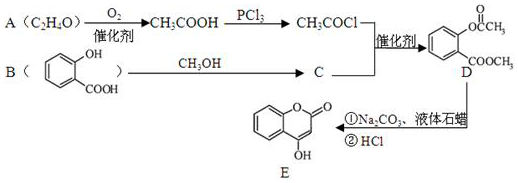
 .
.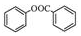 )的合成路线(无机原料任选).
)的合成路线(无机原料任选). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44.8 L氟化氢气体分解成22.4 L的氢气和22.4 L的氟气吸收546.6 kJ热量 | |
| B. | 1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量大于546.6 kJ | |
| C. | 相同条件下,1 mol氢气与1 mol氟气的能量总和高于2 mol氟化氢气体的能量 | |
| D. | 2 mol H-F键的键能比1 mol H-H键和1 mol F-F 键的键能之和大546.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向煮沸的 1 mol•L-1 NaOH 溶液中滴加 FeCl3饱和溶液制备 Fe(OH)3 胶体 | |
| B. | 向混有醋酸的乙酸乙酯中加入饱和 Na2CO3溶液,振荡,分液分离除去乙酸乙酯中的少量醋酸 | |
| C. | 检验甲酸中是否含有甲酸丙酯时,可以往混合液中加入足量 NaOH 溶液以中和甲酸,再滴加银 氨溶液看是否产生银镜 | |
| D. | 用酸性高锰酸钾溶液除去乙烷中少量的乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
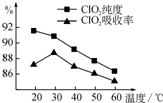 某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液.在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2的吸收率,具体情况如图所示.
某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液.在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2的吸收率,具体情况如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、CH3COO-、Cl- | B. | Mg2+、Ba2+、Br- | ||
| C. | Mg2+、Cl-、I- | D. | Na+、NH4+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中硫酸作氧化剂 | |
| B. | NH4CuSO3中硫元素被氧化 | |
| C. | 刺激性气味的气体是氨气 | |
| D. | 1mol NH4CuSO3完全反应转移0.5mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com