
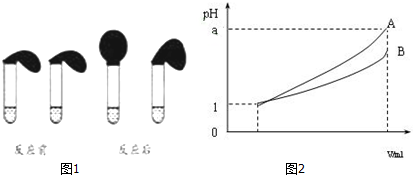
分析 (1)根据配制溶液的体积选用容量瓶的规格;
弱电解质的水溶液中,弱电解质只有部分电离,反应速率与氢离子浓度成正比;
(2)只有改变条件时,才能证明改变条件弱电解质平衡发生移动;
①使HA的电离程度和c(H+)都减小,c(A-)增大,则应该加入含有A-的物质;
②使HA的电离程度减小,c(H+)和c(A-)都增大,则应加入浓的HA溶液;
(3)稀释相同的倍数,A的变化大,则A的酸性比B的酸性强,溶液中氢离子浓度越大,酸性越强,对于一元强酸来说c(酸)=c(H+),但对于一元弱酸,c(酸)>c(H+).
解答 解:(1)配制100mL溶液,需要选用规格为100mL的容量瓶;
弱电解质的水溶液中,弱电解质只有部分电离,则0.1mol•L-1的HA溶液中氢离子浓度小于0.1mol/L,所以溶液的pH>1,反应速率与氢离子浓度成正比,等浓度的HA和盐酸溶液中,HA中氢离子浓度小,所以开始时反应速率慢,则试管上方的气球鼓起慢,
故答案为:100;>,B;
(2)只有改变条件时,才能证明改变条件弱电解质平衡发生移动,所以②能证明改变条件弱电解质平衡发生移动;
①使HA的电离程度和c(H+)都减小,c(A-)增大,则应该加入含有A-的物质,故选A;
②使HA的电离程度减小,c(H+)和c(A-)都增大,则应加入浓的HA溶液,故选D;
故答案为:②,A;D;
(3)A.两种电解质的强弱未知,无法确定两种酸浓度的大小,故A错误;
B.溶液的pH越大,氢离子浓度越小,其酸性越弱,故B正确;
C.若a=4,A完全电离,则A是强酸,B的pH变化小,则B为弱酸,故C正确;
D.pH=1的酸,加水稀释到1000倍,若pH=4,为强酸,若a<4,则A、B 都是弱酸,故D正确;
故答案为:A.
点评 本题考查了探究实验,题目难度中等,知道弱电解质电离特点、明确强酸与弱酸在稀释时pH变化程度大、酸的浓度和氢离子的浓度的关系是解答本题的关键,试题充分考查了学生的分析、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
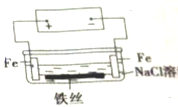
| A. | 原理图可理解为两个串联电解装置 | |
| B. | 溶液中铁丝被腐蚀时,左侧有无色气体产生,附近产生少量白色沉淀,随后变为灰绿色 | |
| C. | 溶液中铁丝左端电极反应式为:Fe-2e-═Fe2+ | |
| D. | 地下管线被腐蚀,不易发现,维修也不便,故应将埋在地下的金属管道表面涂绝缘膜(或油漆等) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2molNH3 |
| 达到平衡的时间/min | 5 | 8 | |
| 平衡时N2的浓度/mol•L-1 | c1 | 1.5 | |
| NH3的体积分数 | φ1 | φ2 | |
| 混合气体的密度/g•L-1 | ρ1 | ρ2 |
| A. | 容器乙中反应从开始到达平衡的反应速率为v(H2)=0.3mol•L-1•min-1 | |
| B. | 在该温度下甲容器中反应的平衡常数K=$\frac{(2-2{c}_{1})^{2}}{{c}_{1}•(3{c}_{1}-1.5)}$ | |
| C. | 2c1<1.5 | |
| D. | 2ρ1=ρ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有能量变化的过程一定是化学变化过程 | |
| B. | 需要加热才能发生的反应是吸热反应 | |
| C. | 化学反应中一定伴有热量的变化 | |
| D. | 物质发生燃烧的反应一定是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
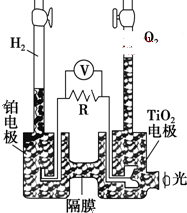 TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.下图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.下图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )| A. | TiO2电极上发生的反应为:2H++2e-═H2↑ | |
| B. | 该装置工作时,TiO2电极附近溶液的pH变大 | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置可以将光能转化为电能,同时也能将其转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2与D2 | B. | T2O与H2O | ||
| C. | ${\;}_{19}^{40}$K与${\;}_{19}^{39}$K | D. | 金刚石与石墨 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com