
 已知A、B、C是中学化学的常见物质,它们在一定条件下有如图转化关系:
已知A、B、C是中学化学的常见物质,它们在一定条件下有如图转化关系:分析 (1)若A能使湿润的红色石蕊试纸变蓝,A为NH3,C为红棕色气体,C为NO2,可推知D为O2、B为NO;
(2)若A焰色反应为黄色,则A为Na,D 常温下是气体,D为O2、B为Na2O、C为Na2O2符合转化关系;
(3)若D金属,C溶液在贮存时应加入少量D,则A为Cl2,D为Fe,B为FeCl3,C为FeCl2;
(4)若A是一种黑色非金属单质,D 是氧化物,A为碳、B为CO、D为H2O、C为CO2符合转化关系.
解答 解:(1)若A能使湿润的红色石蕊试纸变蓝,A为NH3,C为红棕色气体,C为NO2,可推知D为O2、B为NO,则A转化为 B反应的化学程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(2)若A焰色反应为黄色,则A为Na,D 常温下是气体,D为O2、B为Na2O、C为Na2O2符合转化关系,
故答案为:Na2O;
(3)若D金属,C溶液在贮存时应加入少量D,则A为Cl2,D为Fe,B为FeCl3,C为FeCl2,FeCl2溶液在贮存时应加入少量Fe,原因是:Fe2+易被氧化,加入铁粉可防止被氧化,
故答案为:Fe2+易被氧化,加入铁粉可防止被氧化;
(4)若A是一种黑色非金属单质,D 是氧化物,A为碳、B为CO、D为H2O、C为CO2符合转化关系,B与 D 反应的化学方程式为:CO+H2O$\frac{\underline{\;高温\;}}{\;}$CO2+H2,
故答案为:CO+H2O$\frac{\underline{\;高温\;}}{\;}$CO2+H2.
点评 本题考查无机物推断,属于开放性题目,物质的颜色等是推断突破口,注意掌握中学常见连续反应,需要学生熟练掌握元素化合物知识,难度中等.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ | |
| B. | 在溶液中滴加盐酸酸化,在滴加硝酸钡溶液,若有白色沉淀生成则含有SO42- | |
| C. | 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+ | |
| D. | 将气体通入澄清石灰水,溶液变浑浊,证明原气体可能是CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与甲烷发生取代反应,是制取二氯甲烷的有效方法 | |
| B. | 红热的铁丝、铜丝都能在氯气里剧烈燃烧,生成大量白色的烟 | |
| C. | 氯气和次氯酸钠都可用于杀菌、消毒,使用时要注意用量 | |
| D. | 聚氯乙烯是使用量非常大,应用领域最为广泛的塑料,也是熟、热食品常用的包装材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去二氧化碳中混有的少量一氧化碳:通入适量氧气后点燃 | |
| B. | 除去硝酸钾晶体里少量的氯化钠:加水溶解,蒸发结晶至有大量晶体析出,停止加热用余热蒸干 | |
| C. | 除去氮气中少量氧气:使气体通过炽热的铜粉 | |
| D. | 除去氯化钠固体中少量的纯碱:加入足量氯化钙,过滤、蒸发、结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
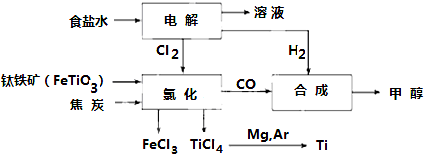
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液密度ρ可表示为$\frac{cMr}{1000w}$ | |
| B. | 物质的量浓度c可表示为$\frac{ρV}{MrV+22.4m}$ | |
| C. | 溶液的质量分数w%可表示为$\frac{MrV}{22.4m}$ | |
| D. | 相对分子质量Mr可表示为$\frac{22.4m×w%}{(1-w%)V}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com