
【题目】硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:O2(g)+S(s)=SO2(g)△H=一akJ/mol
O2(g)+2SO2(g)![]() 2S03(g)△H=-bkJ/mol
2S03(g)△H=-bkJ/mol
写出SO3(g)分解生成O2(g)与S(s)的热化学方程式:_______________________。
(2)研究SO2催化氧化生成SO3的反应,回答下列相关问题:
①甲图是SO2(g)和SO3(g)的浓度随时间的变化情况。反应从开始到平衡时,用SO2表示的平均反应速率为_________。
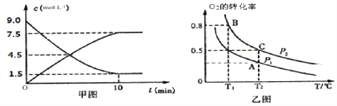
②在一容积可变的密闭容器中充入20molSO2(g)和10molO2(g),02的平衡转化率随温度(T)、压强(P)的变化如图乙所示。则P1与P2的大小关系是P2_____P1(“>”“<”或“=”),A、B、C三点的平衡常数大小关系为______(用K、Kg、K。和“<”“>”或“=”表示)。
(3)常温下,H2SO3的电离平衡常数Ka1=1.5510-2Ka2=1.02×10-7。
①将SO2通入水中反应生成H2SO3。试计算常温下H2SO3![]() 2H++S032-的平衡常数K=____。(结果保留小数点后两位数字)
2H++S032-的平衡常数K=____。(结果保留小数点后两位数字)
②浓度均为0.1mol/L的Na2SO3、NaHSO3混合溶液中,![]() =______________。
=______________。
(4)往1L0.2mol/LNa2SO3溶液中加入等体积的0.1mol/L的CaCl2溶液,充分反应后(忽略溶液体积变化),溶液中c(Ca2+)=______。(已知,常温下Ksp(CaSO3)=1.28×10-9)
【答案】 SO3(g) ![]()
![]() O2(g) + S(s) ΔH=+(a+
O2(g) + S(s) ΔH=+(a+![]() ) kJ·mol-1 0.75mol·(L·min)-1; > KB >KA =Kc 1.58×10-9
) kJ·mol-1 0.75mol·(L·min)-1; > KB >KA =Kc 1.58×10-9 ![]() 或1.5 2.56×10-8mol. L-1
或1.5 2.56×10-8mol. L-1
【解析】(1)已知:①O2(g)+S(s)═SO2(g)△H1=akJ/mol,
②O2(g)+2SO2(g)2SO3(g)△H2=bkJ/mol,
所求反应方程式为:2SO3(g)3O2(g)+2S(s),该反应可由(①×2+②)得到,根据盖斯定律,反应的焓变为△H=(2△H1+△H2)=(2a+b)kJ/mol,故答案为:2SO3(g)3O2(g)+2S(s) △H=(2a+b)kJ/mol;
(2)①SO2催化氧化生成SO3的反应方程式为:O2(g)+2SO2(g)2SO3(g),SO2是反应物,随着反应的进行,浓度降低,SO3是生成物,随着反应的进行,浓度升高,根据图象,下降的是SO2,反应从开始到平衡,经历的时间为△t=10min,SO2的物质的量浓度改变量为9.01.5=7.5mol/L,根据反应关系,O2的物质的量浓度改变量为△c=7.5mol/L2=3.75mol/L,则用O2表示的平均反应速率为v(O2)=△c/△t=3.75mol/L/10min=0.375mol/(Lmin),故答案为:0.375mol/(Lmin);
②反应方程式为:O2(g)+2SO2(g)2SO3(g),随着反应的进行,气体分子数减小,体系压强降低,结合图象采用控制变量法分析,当温度相同时,增大体系压强,有利于化学反应平衡向正反应方向移动,反应物的转化率升高,因此增大压强,可以增大O2的平衡转化率,则P1与P2的大小关系是P1<P2,温度相同,化学平衡常数不改变,该反应的焓变小于0,因此反应是放热反应,降低温度有利于反应正向进行,则A. B.C三点的平衡常数大小关系为KA=KC<KB,故答案为:KA=KC<KB;
(3)①常温下H2SO32H++SO32的平衡常数K,根据多重平衡规则,反应的平衡常数K=c2(H+)c(SO32)/c(H2SO3)=Ka1Ka2=1.54×102×1.02×107=1.57×109故答案为:1.57×109;
②浓度均为0.1mol/L的Na2SO3、NaHSO3混合溶液,对于Na2SO3溶液,根据物料守恒:c(Na+)=2c(SO32)+2(HSO3)+2(H2SO3),对于NaHSO3溶液,根据物料守恒:c(Na+)=c(SO32)+(HSO3) +(H2SO3),对于浓度相同的Na2SO3、NaHSO3混合溶液,设混合溶液中有V1L Na2SO3、V2L NaHSO3,则混合溶液中,c(Na+)=(2×0.1V1+0.1V2)/V1+V2,c(SO32)+(HSO3)+(H2SO3)=(0.1V1+0.1V2)/(V1+V2),因此混合溶液中,c(Na+)/[c(SO23)+c(HSO3)+c(H2SO3)]=3/2,故答案为:32;
(4)1L 0.2mol/LNa2SO3溶液中加入span>0.1mol的CaCl2固体,充分反应后(忽略溶液体积变化),反应生成CaSO3,溶液中起始时,c(Ca2+)=0.1mol/L,c(SO32)=0.2mol/L,发生反应为Ca2++SO32═CaSO3,反应后,溶液中剩余c(SO32)=0.2mol/L0.1mol/L=0.1mol/L,则溶液中此时c(Ca2+)=Ksp(CaSO3)/c(SO32)=1.28×108mol/L,故答案为:1.28×108mol/L;


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下。
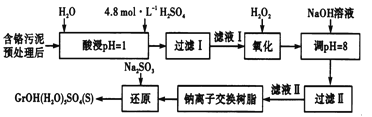
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(l)实验室用18.4mol/L的浓硫酸配制225mL4.8mol/L的H2SO4溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要__________________。
(2)酸浸时,为了提高浸取率除了增大酸的浓度外还可采取的措施有______(答出一点即可)。
(3)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式______。
(4)常温下,部分阳离子以氮氧化物形式沉淀时,溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ |
开始沉淀时的pH | 2.7 | — | — |
沉淀完全时的pH | 3.7 | 11.1 | 8 |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-溶液的pH不能超过8,其理由_______。
(5)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去的滤液Ⅱ中的金属阳离子是____________。
(6)写出上述流程中用Na2SO3进行还原时发生反应的化学方程式_______,在实验室进行过滤操作时,为了加快过滤速率,可以采取的措施为_________(写一种方法即可).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种不同的物质中均含有同一种元素,它们之间存在如图所示的转化关系(部分反应物及生成物已略去).请回答下列问题:

(1)若常温时B为红棕色气体,C为无色气体,则B生成C的化学方程式:____________________________
(2)若常温时A为气态氢化物,B为淡黄色固体,C为气体,则CO2中混有少量气体C杂质可以用__________来除(写一种即可).
(3)若A为碱性氧化物,B为工业制玻璃的主要原料之一,常温时0.1mol/L的C溶液的pH值为13,则反应①的方程式为_______________________检验A、B、C中共有的金属离子的方法是 ____________。
(4)若常温时A为气体单质,①②③④均为化合反应,C的相对分子质量大于B,则C的电子式为:__________。
(5)若A是第三周期某金属的氧化物,B、C均为正盐且B的水溶液呈酸性,C的水溶液呈碱性。请写出反应③的离子方程式:______________________________________________________。
(6)若反应②③④均为化合反应,反应①为置换反应。当A为一种金属单质时,B中阳离子的检验方法为 ____________________________________________。(写出具体操作过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属镁和铁的说法中不正确的是 ( )
A.两者均能与盐酸反应
B.两者在常温下表面均易形成致密氧化膜,保护内层金属不被氧化
C.镁条点燃时发出耀眼的白光
D.一定条件下,铁与氧气、氯气、硫等非金属单质均能发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Al2H6燃烧热极高,是一种很好的生氢剂,它跟水反应生成H2,球棍模型如图(白球为Al,黑球为H)。下列推测肯定不正确的是

A. 该物质与水反应,属于氧化还原反应
B. Al2H6分子中氢为+1价,铝为﹣3价
C. Al2H6在空气中完全燃烧,产物为氧化铝和水
D. 氢铝化合物可能成为未来的储氢材料和火箭燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】达康书记又问沙瑞金书记:在可回收垃圾中制作易拉罐的主要材质有几种?其中有一种在元素周期表中的位置是
A. 一种,二周期IIA族 B. 两种,三周期IIA族
C. 两种,三周期IIIA族 D. 三种,四周期IA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去其中较多量杂质的方法(括号内的物质是杂质)正确的是
A. 乙酸乙酯(乙酸):用氢氧化钠溶液洗涤,然后分液。
B. 苯(苯酚):用氢氧化钠溶液洗涤,然后过滤。
C. 硝基苯(苯):用水浴蒸馏。
D. 乙醇(水):加入生石灰搅拌后过滤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①菜籽油和氯化钠溶液、②75%的医用酒精、③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.过滤 萃取 分液B.萃取 分液 蒸馏
C.分液 蒸馏 萃取D.萃取 蒸馏 分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“ Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,放电反应方程式为4Na+3CO2 =2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示,下列说法中错误的是( )

A. 电流流向为:MWCNT→导线→钠箔
B. 放电时,正极的电极反应式为 3CO2+4Na++4e-===2Na2CO3+C
C. 原两电极质量相等,若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为11.2g
D. 选用髙氯酸钠-四甘醇二甲醚做电解液的优点是导电性好,与金属钠不反应,难挥发
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com