
【题目】为探究某固体氧化物A(仅含两种元素)的组成和性质,设计并完成如下实验,。请回答:

(1)固体A的化学式______________。
(2)单质B在氯气中反应的现象_______________________________。
(3)写出C→D在溶液中发生氧化还原反应的离子方程式_______________________________。
【答案】Fe3O4 剧烈燃烧,生成棕褐色的烟 2Fe3+ + SO2 + 2H2O = 2Fe2++SO42- + 4H+
【解析】
由图可知,红褐色沉淀F为Fe(OH)3,溶液D中含硫酸根离子,白色沉淀E为BaSO4,结合元素守恒可知固体C为FeCl3,单质B为Fe,其物质的量为![]() =0.3mol,如A为FeO,其质量为0.3mol×72g/mol=21.6g,如A为Fe2O3,其质量为0.3mol×
=0.3mol,如A为FeO,其质量为0.3mol×72g/mol=21.6g,如A为Fe2O3,其质量为0.3mol×![]() ×160g/mol=24g,A的质量为23.2g,则A应为Fe3O4,满足0.3mol×
×160g/mol=24g,A的质量为23.2g,则A应为Fe3O4,满足0.3mol×![]() ×232g/mol=23.2g,以此来解答。
×232g/mol=23.2g,以此来解答。
(1)由上述分析可知,A为Fe3O4;
(2)Fe在氯气中燃烧生成氯化铁,则现象为剧烈燃烧,生成棕褐色的烟;
(3)C→D在溶液中发生氧化还原反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+。


科目:高中化学 来源: 题型:
【题目】汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化还原法消除NOx的转化如下所示:
NO![]() NO2
NO2![]() N2
N2
①反应Ⅰ为NO+O3===NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是____mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,氧化产物与还原产物的质量比为__。
(2)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。
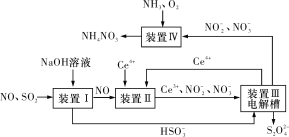
装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式:__。
(3)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的__(填“阳极”或“阴极”),同时在另一极生成S2O42-的电极反应式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作对应的现象不符合事实的是
|
|
|
|
A.少量二氧化硫通入氯化钡溶液中,产生白色沉淀亚硫酸钡 | B.在新制Cu(OH)2悬浊液中加入少量的葡萄糖,加热,产生砖红色沉淀 | C.将少量钠投入到无水乙醇中,钠表面有气泡产生 | D.在盛水的烧杯中加入氯化钠固体,小灯泡会逐渐亮起来 |
A. AB. BC. C...D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,关于浓度相同的![]() 和
和![]() 溶液,下列判断不正确的是
溶液,下列判断不正确的是
A. 粒子种类不相同
B. ![]() 前者大于后者
前者大于后者
C. 均存在电离平衡和水解平衡
D. 分别加入![]() 固体,
固体,![]() 均增大
均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列事实的解释,其原理表示不正确的是
A. 常温下,测得![]() 氨水的pH为11:
氨水的pH为11:![]()
B. 将![]() 通入水中,所得水溶液呈酸性:
通入水中,所得水溶液呈酸性:![]()
C. 用![]() 、
、![]() 进行氢氧燃料电池实验,产生电流:
进行氢氧燃料电池实验,产生电流:![]()
D. 恒温恒容时,![]() 平衡体系中,通人
平衡体系中,通人![]() ,平衡正向移动:通入
,平衡正向移动:通入![]() 后,体系中的
后,体系中的![]() 值小于平衡常数K
值小于平衡常数K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是:
A. 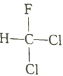 和
和 互为同分异构体
互为同分异构体
B. 15g甲基(﹣CH3)含有的电子数是9NA
C. 7.8g苯中含有的碳碳双键数为0.3NA
D. 标准状况下,2.24 L CCl4中的原子总数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的循环在自然界元素的循环中具有重要的意义,有些氮的转化是从氮气转化为含氮的化合物,有的转化发生在含氮的化合物之间。下列过程中,以游离态的氮为原料,最终产生含氮的化合物的是( )
A.汽车尾气中的氮氧化物形成酸雨B.硝化细菌的硝化过程
C.动物尸体腐烂D.豆科植物的根瘤菌固氮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中模拟“侯氏制碱法”,其实验步骤如下:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让某一装置发生反应,直到产生的气体不能再在C中溶解,再通入另一装置中产生的气体,一段时间后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:分离C中所得的混合物,得到NaHCO3固体,进而生产出纯碱。
第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出。
(1)下图所示装置的连接顺序是:a接_______,_______接______;b接_______(填接口序号)。
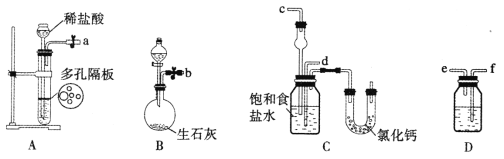
(2)A中常选用的固体反应物为_________;D中应选用的液体为____________。
(3)第二步中让___________装置先发生反应(填装置序号)。
(4)C中用球形干燥管而不用直导管,其作用是____________________;装有无水CaCl2的U形管的作用是__________________________。
(5)第三步分离出NaHCO3固体的操作是__________________________。
(6)第四步中所加固体粉末化学式为___________。所得的晶体中常含有少量的NaCl和NaHCO3(共约占5%~8%),请设计一个简单的实验,不使用其他任何试剂,证明所得晶体大部分是NH4C1。简要写出操作和现象:____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com