
罗马大学Fulvio Cacace等人获得了极具理论研究意义的N4分子,N4分子结构与白磷P4相似。已知断裂1 mol N—N键吸收167 kJ热量,生成 1 mol N≡N键放出 942 kJ 热量。由此判断下列说法正确的是
A.N4属于一种新型的化合物,分子内存在非极性键
B.N4与N2互为同位素,化学性质相似,物理性质不同
C.N4沸点比P4(白磷)高
D.1 mol N4气体转变为N2将放出882 kJ热量
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
已知乙醇可以和氯化钙反应生成微溶于水的CaCl2·6C2H5OH。有关的有机试剂的沸点如下:CH3COOC2H5为77.1℃;C2H5OH为78.3℃;C2H5OC2H5(乙醚)为34.5℃;CH3COOH为118℃。实验室合成乙酸乙酯粗产品的步骤如下:在蒸馏烧瓶内将过量的乙醇与少量浓硫酸混合,然后经分液漏斗边滴加醋酸,边加热蒸馏。由上面的实验可得到含有乙醇、乙醚、醋酸和水的乙酸乙酯粗产品。
(1)反应中加入的乙醇是过量的,其目的是 。
(2)边滴加醋酸,边加热蒸馏的目的是 。
将粗产品再经下列步骤精制:
(3)为除去其中的醋酸,可向产品中加入 (填字母)。
A.无水乙醇 B.碳酸钠粉末 C.无水醋酸钠
(4)再向其中加入饱和氯化钙溶液,振荡,分离,其目的是 。
(5)然后再向其中加入无水硫酸铜,振荡,其目的是 。最后,将经过上述处理后的液体加入另一干燥的蒸馏瓶内,再蒸馏,弃去低沸点馏分,收集沸点在76℃~78℃之间的馏分即得纯净的乙酸乙酯。
查看答案和解析>>
科目:高中化学 来源: 题型:
煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应 的热化学方程式如下:
的热化学方程式如下:
CaSO4(s)+CO(g)  CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ)
CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)  CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ)
CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ)
请回答下列问题:
(1)反应Ⅰ能自发进行的条件是 。
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B) 的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅱ的Kp= (用表达式表示)。
的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅱ的Kp= (用表达式表示)。
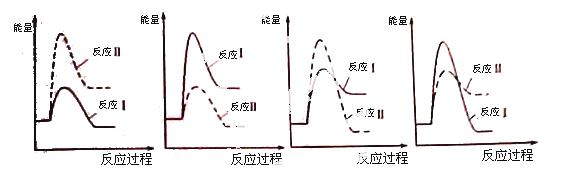
(3)假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是 。
(4)通过监测反应体系中气体浓度的变化判断反应Ⅰ和Ⅱ是否同时发生,理由是 。
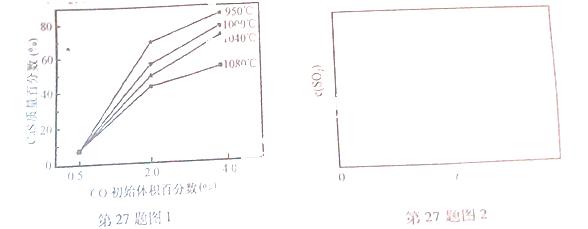
(5)图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有 。
A.向该反应体系中投入石灰石
B.在合适的温度区间内控制较低的反应温 度
度
C.提高CO的初始体积百分数
D.提高反应体系的温度
(6)恒温恒容条件下,假设反应Ⅰ和Ⅱ同时发生,且v1>v2,请在图2中画出反应体系中c(SO2)随时间t变化的总趋势图。
查看答案和解析>>
科目:高中化学 来源: 题型:
居里夫人因对Ra(镭)元素的研究两次获得诺贝尔奖。人们在测定物质放射性时通常用
 Ra作为标准。下列有关
Ra作为标准。下列有关 Ra的说法正确的是
Ra的说法正确的是
A.226是Ra元素的相对原子质量
B.226是Ra元素的近似相对原子质量
C.226Ra的相对原子质量为226
D.226Ra的质量数为226,在数值上等于该原子的近似相对原子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,RO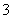 与R-可发生反应:RO
与R-可发生反应:RO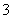 +5R-+6H+===3R2+3H2O,下列关于R元
+5R-+6H+===3R2+3H2O,下列关于R元
素的叙述中,正确的是
A.元素R位于周期表中第Ⅴ A族
B.RO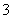 中的R只能被还原
中的R只能被还原
C.R2在常温常压下一定是气体
D.若1 mol RO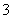 参与该反应,则转移的电子的物质的量为5 mol
参与该反应,则转移的电子的物质的量为5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关金属冶炼的说法中,不正确的是
A.用电解熔融氯化镁的方法冶炼金属镁
B.在加热情况下利用氢气还原三氧化二铝得到金属铝
C.用铝热法炼得熔点较高的金属铬
D.直接加热氧化汞得到金属汞
查看答案和解析>>
科目:高中化学 来源: 题型:
既可以用来鉴别乙烯和甲烷,又可用来除去甲烷中混有的乙烯的方法是
A.通入足量溴的四氯化碳溶液中
B.与足量的液溴反应
C.通入酸性高锰酸钾溶液中
D.一定条件下与H2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(1)写出D与E以1∶1的原子个数比形成的化合物的电子式:________。F的原子结构示意图为________。
(2)B、D形成的化合物BD2中存在的化学键为________键(填“离子”或“共价”,下同)。A、C、F三种元素形成的化合物CA4F为________化合物。
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为_________________________________________________。
(4)A、C、D、E的原子半径由大到小的顺序是________(用元素符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性________于F(填“强”或“弱”),并用化学方程式证明上述结论____________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com