
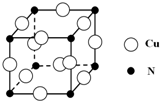
| A. | 粗铜电解精炼时,应将粗铜与直流电源的正极相连 | |
| B. | 金属的吸氧腐蚀的过程中,正极的电极反应式为O2+4e-+2H2O═4OH- | |
| C. | 燃料电池中加入燃料的电极一定是电池的负极 | |
| D. | 在生产生活中,为保护钢铁器件免受腐蚀,应将该器件与直流电源的正极相连 |
分析 A.粗铜电解精炼时,粗铜为阳极,纯铜为阴极;
B.发生吸氧腐蚀时,正极上氧气被还原;
C.原电池中,负极发生氧化反应;
D.应将该器件与直流电源的正极相连,加速金属的腐蚀.
解答 解:A.粗铜电解精炼时,粗铜为阳极,纯铜为阴极,粗铜被氧化,在阴极上析出铜,故A正确;
B.发生吸氧腐蚀时,正极上氧气被还原,电极方程式为O2+4e-+2H2O═4OH-,故B正确;
C.原电池中,负极发生氧化反应,燃料为负极,故C正确;
D.钢铁保护时应将器件与直流电源负极相连,故D错误.
故选D.
点评 本题考查了原电池原理,为高考高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,明确原电池的构成、电极上发生的反应、电流的流向即可解答,难度不大.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:解答题
 硼和氮元素在化学中有很重要的地位,回答下列问题:
硼和氮元素在化学中有很重要的地位,回答下列问题: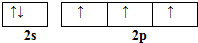 .预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3.
.预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3.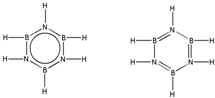 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 试剂 | 提纯方法 |
| A | BaSO4 | BaCO3 | 水 | 溶解、过滤、洗涤 |
| B | CO2 | SO2 | 饱和 Na2CO3 溶液 | 洗气 |
| C | 乙烷 | 乙烯 | 酸性 KMnO4 溶液 | 洗气 |
| D | 蛋白质 | 葡萄糖 | 浓 (NH4)2SO4 溶液 | 盐析、过滤、洗涤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热浓缩到溶液体积为$\frac{V}{2}$ L | |
| B. | 加入0.05 mol•L-1盐酸0.125V L | |
| C. | 加入10 mol•L-1盐酸0.1V L,再稀释至1.5V L | |
| D. | 标准状况下通入11.2 L氯化氢气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊溶液褪色 | |
| B. | 能使品红溶液褪色的不一定是SO2 | |
| C. | SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同 | |
| D. | SO2和Cl2等物质的量混合后同时通入装有湿润的有色布条的集气瓶中,漂白效果更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③④⑤⑥ | C. | ①③④ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②反应均是氧化还原反应 | |
| B. | KI在整个反应过程中起催化作用 | |
| C. | KI在整个反应过程中起氧化作用 | |
| D. | “溶液突然变为蓝色,随之又很快消失”这一现象与①②的反应速率有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
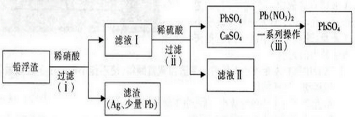
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com