
【题目】X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增.已知X的最外层电子数是次外层电子数的3倍,X、M同主族,Y在同周期主族元素中原子半径最大,Z的最高化合价与最低化合价的代数和为零.下列说法正确的是
A.单质的氧化性:X>M
B.气态氢化物的热稳定性:M>N
C.X与Y简单离子半径:r(X离子)<r(Y离子)
D.化合物ZX2与ZN4含有相同类型的化学键
【答案】AD
【解析】
X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增,已知X的最外层电子数是次外层电子数的3倍,则X是O元素;X、M同主族,且M的原子序数大于X,所以M是S元素;Y在同周期主族元素中原子半径最大,且原子序数大于X的短周期元素,则Y是Na元素;Z的最高化合价与最低化合价的代数和为零,且原子序数大于Y,所以Z是Si元素;N是原子序数大于M的短周期主族元素,所以N是Cl元素。
X、Y、Z、M、N依次是氧、钠、硅、硫、氯;
A.X是氧,M是硫,同一主族元素中,随着原子序数的增大元素的非金属性逐渐减弱,其单质的氧化性逐渐减弱,氧化性:![]() ,A正确;
,A正确;
B.氯的非金属性大于硫,非金属性越强气态氢化物越稳定,故![]() ,B错误;
,B错误;
C.![]() 和
和![]() 核外电子排布相同,质子数越小半径越大,故
核外电子排布相同,质子数越小半径越大,故 ![]() ,C错误;
,C错误;
D.化合物![]() 与
与![]() 都是共价化合物,都只含极性共价键,所以含有相同类型的化学键,D正确;
都是共价化合物,都只含极性共价键,所以含有相同类型的化学键,D正确;
故答案选AD。


科目:高中化学 来源: 题型:
【题目】为探究某橙色含结晶水的盐X的组成和性质,设计并完成如图实验。请回答:

(1)X的化学式是___。
(2)乙化学性质与其组成元素的单质相似,下列物质中能与乙发生反应的是__(填写相应的字母)。
A.Mg B.CaCl2 C.NaOH D.K2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按下列要求填空:
(1)甲基的电子式__________;
(2)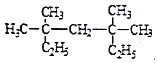 系统命名法为_________________;
系统命名法为_________________;
(3)键线式![]() 表示的有机物的结构简式是____________;
表示的有机物的结构简式是____________;
(4)烷烃A在同温同压下蒸气的密度是H2的36倍,烷烃A的结构简式为________________.
(5)相对分子质量为70的烯烃的分子式为_________,若该烯烃与足量H2加成后能生成含3个甲基的烷烃,则该烯烃可能的结构简式为_________。
(6)写出下列反应的化学方程式:
①实验室制取乙炔_____________________________________________________。
②2 -氯丙烷的消去反应_____________________________________________________。
③用甲苯制TNT的反应_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“>”、“<”或“=”填空:
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),光照和点燃条件的ΔH(化学计量数相同)分别为ΔH1、ΔH2,ΔH1______ΔH2;
(2)相同条件下,2mol氢原子所具有的能量____1mol氢分子所具有的能量;
(3)已知常温时红磷比白磷稳定,比较下列反应中ΔH的大小:ΔH1_____ΔH2。
①4P(白磷,s) +5O2(g)=2P2O5(s) ΔH1,②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;
(4)已知:101 kPa时,2C(s) +O2(g)=2CO(g) ΔH=-221kJ·mol-1,则碳的燃烧热数值____110.5 kJ·mol-1;
(5)已知:稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,则浓硫酸与稀NaOH溶液反应生成1 mol水,放出的热量________57.3 kJ;
(6)可逆反应:aA(气)+bB(气)![]() cC(气)+dD(气);ΔH=Q,根据图回答:
cC(气)+dD(气);ΔH=Q,根据图回答:

P1______ P2;②(a+b)______(c+d);③t1℃______ t2℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 乙酸与碳酸钠溶液反应:2H++CO32—== CO2↑+H2O
B. 醋酸溶液与新制氢氧化铜反应:CH3COOH+OH-→CH3COO-+H2O
C. 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O →2C6H5OH+CO32—
D. 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH-![]() CO32—+2NH4++4Ag↓+6NH3+2H2O
CO32—+2NH4++4Ag↓+6NH3+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关键环节题组:有机合成路线设计
(1)用丙醛(CH3—CH2—CHO)制取聚丙烯的过程中发生的反应类型为________
①取代 ②消去 ③加聚 ④缩聚 ⑤氧化 ⑥还原
A.⑥②③ B.⑤②③ C.②④⑤ D.①④⑥
(2)以CH2==CHCH2OH为主要原料(无机试剂任用)设计CH2==CHCOOH的合成路线流程图(已知CH2=CH2可被氧气催化氧化为 ![]() )_________________
)_________________
学法题:通过此题的解答,总结设计有机合成路线需注意(至少写2条)___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子.在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl2·2CO·2H2O
(1)X基态原子的电子排布式为__________________.
(2)C、H、O三种原子的电负性由大到小的顺序为__________.
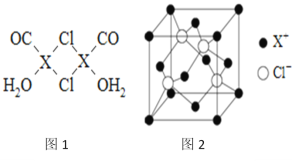
(3)X2Cl2·2CO·2H2O是一种配合物,其结构如图1所示:
①与CO为互为等电子体的分子是_________.
②该配合物中氯原子的杂化方式为__________.
③在X2Cl22CO2H2O中,每个X原子能与其他原子形成3个配位键,在图中用“→”标出相应的配位键_____________.
(4)阿伏加德罗常数的测定有多种方法,X射线衍射法就是其中的一种。通过对XCl晶体的X射线衍射图象的分析,可以得出XCl的晶胞如图2所示,则距离每个X+最近的Cl﹣的个数为____________,若X原子的半径为a pm,晶体的密度为ρg/cm3,试通过计算阿伏加德罗常数NA=___________________(列计算式表达)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组进行Cu和Fe2(SO4)3溶液的实验。实验探究过程如下:
实验装置:
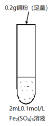
实验操作与现象: ⅰ.加入Cu粉后充分振荡,静置,溶液变成浅蓝绿色;
ⅱ.取少量ⅰ中清液于试管中,滴加3滴0.1mol/L KSCN溶液,立即出现白色沉淀,溶液局部变为红色,振荡后红色迅速褪去。
查阅资料:
Ⅰ.Cu2+可与SCN-反应生成CuSCN(白色沉淀)和(SCN)2: (SCN)2的性质与Cl2相似。
Ⅱ.CuSCN能与稀硝酸反应:CuSCN+HNO3→CuSO4+N2↑+CO2+H2O(未配平)。
回答下列问题:
(1)Cu和Fe2(SO4)3溶液反应的离子方程式为________。
(2)根据表中实验现象推断白色沉淀为___________。为验证该白色沉淀,取少量白色沉淀于试管中,加入___,若____即可证明(补充所加试剂及实验现象)。
(3)试解释ⅱ中溶液局部变为红色的原因是______。
(4)根据ⅱ中实验现象可推知SCN-更易与_______结合(填“Fe3+”或“Cu+”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的前四周期元素。其中X是形成化合物种类最多的元素,Y原子基态时2p原子轨道上有3个未成对的电子,Z单质占空气体积的![]() ,W的内层电子全充满,最外层只有1个电子。请回答下列问题:
,W的内层电子全充满,最外层只有1个电子。请回答下列问题:
(1)X、Y、Z的电负性从大到小的顺序是___ (用元素符号表示,下同),三种元素的第一电离能由大到小的顺序为______。
(2)写出X的电子排布式_____。
(3)W同周期的元素中,与W原子最外层电子数相等的元素还有_____。
(4)X、Y、Z的简单氢化物的键角从大到小的顺序是____(用化学式表示),原因是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com