
【题目】2SO2(g)+O2(g)![]() 2SO3(g)+Q,是接触法生产硫酸的主要反应之一。
2SO3(g)+Q,是接触法生产硫酸的主要反应之一。
完成下列填空:
(1)生产过程中温度控制在400℃~500℃,目的是__________________________________;该反应无需加压的原因是____________________________________________________。
(2)上述反应在密闭容器中达到化学平衡状态的标志为______________________________。
(3)上述反应的平衡常数表达式为__________________________________,随着温度升高,平衡常数__________________(选填“增大”、“减小”或“不变”)。
(4)接触法生产硫酸尾气中含有SO2,可以采用氨水吸收,生成(NH4)2SO3与NH4HSO3的混合溶液。反应所得(NH4)2SO3又可以将NO2转化为N2和(NH4)2SO4。
① 写出生成NH4HSO3的化学方程式__________________________________________。
② 书写NO2与(NH4)2SO3反应的化学方程式,标出该反应中电子转移的方向和数目__________________________________。
【答案】 确保催化剂的活性最高 该条件下SO2的转化率已经很高,增大压强对提高SO2的转化率无显著影响,反而会增加成本 容器中气体的平均相对分子质量不随时间而变化(合理即可) K=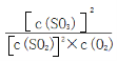 减小 NH3+H2O+SO2=NH4HSO3
减小 NH3+H2O+SO2=NH4HSO3 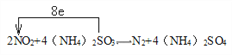
【解析】(1)考查化学反应条件的控制,此反应的正反应是放热反应,需要加入催化剂,因此控制温度在400℃~500℃的目的时保证催化剂的催化效率最高;因为在常压下,SO2的转化率已经很高,再增大压强,SO2的转化率提高不大,反而增加成本;(2)考查化学平衡状态的判断,容器中气体的平均相对分子质量不随时间而变化、组分的浓度不再改变等;(3)考查化学平衡常数,以及影响化学平衡常数的因素,根据化学平衡常数的定义,此反应的化学平衡常数K=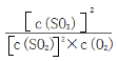 ;化学平衡常数只受温度的影响,因为此反应的正反应是放热反应,因此升高温度,化学平衡常数减小;(4)考查化学反应方程式的书写、电子转移方向和数目,①SO2在某些性质上与CO2的性质相似,向氨水中通入SO2,先发生SO2+2NH3+H2O=(NH4)2SO3,继续通入SO2,则发生(NH4)2SO3+SO2+H2O=2NH4HSO3,因此生成NH4HSO3的总反应是NH3+H2O+SO2=NH4HSO3;②根据题中信息,(NH4)2SO3+NO2→N2+(NH4)2SO4,根据化合价升降法进行配平,得出2NO2+4(NH4)2SO3=N2+4(NH4)2SO4,表示转移电子方向和数目为
;化学平衡常数只受温度的影响,因为此反应的正反应是放热反应,因此升高温度,化学平衡常数减小;(4)考查化学反应方程式的书写、电子转移方向和数目,①SO2在某些性质上与CO2的性质相似,向氨水中通入SO2,先发生SO2+2NH3+H2O=(NH4)2SO3,继续通入SO2,则发生(NH4)2SO3+SO2+H2O=2NH4HSO3,因此生成NH4HSO3的总反应是NH3+H2O+SO2=NH4HSO3;②根据题中信息,(NH4)2SO3+NO2→N2+(NH4)2SO4,根据化合价升降法进行配平,得出2NO2+4(NH4)2SO3=N2+4(NH4)2SO4,表示转移电子方向和数目为 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】I. 某实验小组对H2O2的分解做了如下探究。下表是研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 mL5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
块状 | 微热 | 反应较慢,火星红亮,但木条未复燃 | 30 min |
(1)该反应是_________反应(填“放热”或“吸热”)。
(2)实验结果表明,催化剂的催化效果与_____________有关。
Ⅱ.某可逆反应在体积为5 L的密闭容器中进行,0~3分钟内各物质的物质的量变化情况如图所示(A、B、C均为气体)。
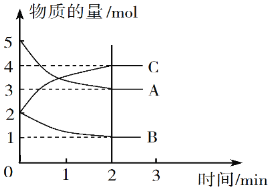
(3)该反应的化学方程式为_____________。
(4)反应开始至2分钟时,B的平均反应速率为__________。
(5)能说明该反应已达到平衡状态的是_________(填字母)。
A.v(A)= 2v(B) B.容器内压强保持不变
C.v逆(A)= v正(C) D.容器内混合气体的密度保持不变
Ⅲ.已知:断开1 mol共价键吸收的能量或形成1 mol共价键释放的能量数据如下表:
共价键 | H—H | N—H | N≡N |
能量变化/kJ·mol1 | 436 | 390.8 | 946 |
(6)已知合成氨反应:N2(g)+3H2(g)![]() 2NH3(g),则N2(g)与H2(g)反应有2 mol NH3(g)生成时,能量的变化情况是_________(填“吸收”或“放出”以及具体数值)kJ。
2NH3(g),则N2(g)与H2(g)反应有2 mol NH3(g)生成时,能量的变化情况是_________(填“吸收”或“放出”以及具体数值)kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源特点的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A. ①②③④ B. ⑤⑥⑦⑧ C. ①③⑥⑧ D. ②④⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示三个烧瓶中分别装人含酚酞的0.01mol/LCH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质.则下列叙述正确的是( ) 
A.①说明水解反应为放热反应
B.③说明水解反应为吸热反应
C.①中溶液红色变浅
D.③中溶液红色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲测定某已部分变质的小苏打样品中Na2CO3的质量分数,设计如下实验方案。
【方案一】称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为_______________。
(2)实验中,需加热至恒重的目的是_______________。
【方案二】称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤、干燥沉淀,称量固体质量,计算。(已知:Ba2++OH-+HCO3-==BaCO3↓+H2O)
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为_______________。
(3)实验中判断沉淀是否完全的方法是_______________。
【方案三】按如下图所示装置进行实验:
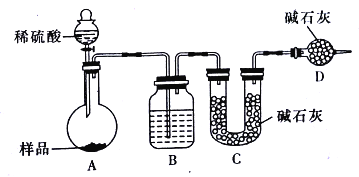
(1)D装置的作用是_______________。分液漏斗中_________(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.90g样品,实验后测得C装置增重8.80g,则样品中Na2CO3的质量分数为________________(保留三位有效数字)
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存的在一个明显缺陷是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示(乙装置中X为阳离子交换膜,甲醚的结构简式为CH3OCH3) 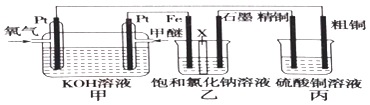
根据要求回答下列相关问题:
(1)写出负极的电极反应: .
(2)氢氧化钠主要在(填“铁极”或“石墨极”)区生成.
(3)如果粗铜中含有锌、银等杂质,则粗铜的电极反应为:、 .
(4)反应一段时间,硫酸铜溶液的浓度将(填“增大”、“减小”或“不变”).
(5)若在标准状况下有2.24L氧气参加反应,丙装置中阴极析出铜的质量为 .
(6)若将丙装置改成在标准状况下,用石墨作电极电解体积为2L的CuSO4溶液,写出电解CuSO4溶液时的离子反应方程式;当电解适当时间后断开电源,发现只需补充22.2g固体Cu2(OH)2CO3即可使电解液恢复到原浓度与体积,则原CuSO4溶液的浓度是mol/L;若将丙设计成在镀件上镀铜的装置,该如何改动,请用简要的语言叙述: .
(7)若将乙中的交换膜去掉,发现只有H2逸出,则试写出乙池中发生的总反应: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图: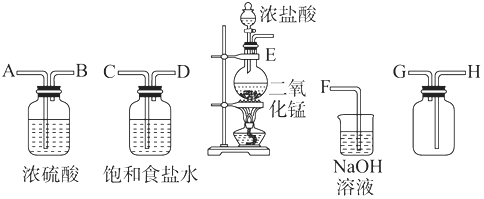
(1)连接上述仪器的正确顺序(填各接口处的字母):接;接;接;接 .
(2)装置中,饱和食盐水的作用是;NaOH溶液的作用是 .
(3)化学实验中常用湿润的淀粉KI试纸检验是否有Cl2产生.如果有Cl2产生,可观察到 , 反应方程式 .
(4)写出下列化学反应的方程式:
①气体发生装置中进行的反应: .
②NaOH溶液中发生的反应: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,电流表指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液,

下列说法错误的是
A. B极为原电池的正极
B. A、B、C可能分别为Zn、Cu、稀盐酸
C. C中阳离子向A极移动
D. A极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M( ![]() )
)
是牙科粘合剂, X是高分子金属离子螯合剂,以下是两种物质的合成路线:
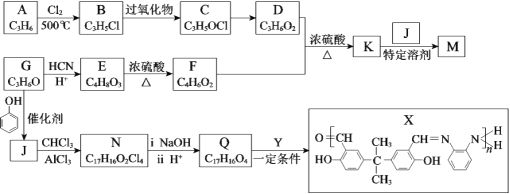
已知:R、R1、R2代表烃基或其他基团
![]()
![]()
![]()
(1)A为烯烃,B中所含官能团名称是______,A→B的反应类型是______。
(2)C→D的反应条件是______。
(3)E分子中有2个甲基和1个羧基,E→F的化学方程式是______。
(4)D+F→K的化学方程式是______。
(5)下列关于J的说法正确的是______。
a.可与Na2CO3溶液反应
b.1 mol J与饱和溴水反应消耗8 mol Br2
c.可发生氧化、消去和缩聚反应
(6)G分子中只有1种氢原子,G→J的化学方程式是______。
(7)N的结构简式是______。
(8)Q+Y→X的化学方程式是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com