
【题目】(1)下列物质N2、H2O、Na2O2、CaCl2、KOH、NaF中,既含有离了键,又含有共价键的物质是_____,属于共价化合物的是__________。
(2)用电子式表示CaCl2的形成过程:________________。
(3)氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用产生NH3。请写出NH3的电子式是____________。
(4)Na3N与盐酸反应生成两种盐,反应的化学方程式为____________。
【答案】Na2O2、KOH H2O ![]()
![]() Na3N+4HCl==3NaCl+NH4Cl
Na3N+4HCl==3NaCl+NH4Cl
【解析】
一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键;全部由共价键形成的化合物是共价化合物。
(1)N2中只含有共价键,H2O中只含有共价键,Na2O2中既含有离子键又有共价键,CaCl2中只含有离子键,KOH中既含有离子键又有共价键,NaF中只含有离子键,因此既含有离子键,又含有共价键的物质是Na2O2、KOH,属于共价化合物的是H2O。答案:Na2O2、KOH;H2O。
(2)氯化钙是离子化合物,含有离子键,则用电子式表示CaCl2的形成过程为![]() 。答案:
。答案:![]()
(3)氮化钠(Na3N)与水作用产生NH3,,NH3的电子式是:![]() 。答案:
。答案:![]() 。
。
(4)Na3N与盐酸反应生成两种盐,根据原子守恒可知应该是氯化钠和氯化铵,因此反应的化学方程式为Na3N+4HCl=3NaCl+NH4Cl;答案:Na3N+4HCl=3NaCl+NH4Cl。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. pH=7的溶液:K+、Na+、Cl-、Fe3+
B. 能使酚酞显红色的溶液:Na+、Mg2+、HCO3-、SO42-
C. c(H+)/c(OH-)=1012的溶液:K+、Fe3+、Cl-、SO42-
D. 水电离出的c(H+)=10-13 mol·L-1的溶液:Ca2+、NH4+、NO3-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇是一种重要的化工产品,可利用甲醇催化脱氢制备甲醛。甲醛与气态甲醇转化的能量关系如图所示。

反应过程中的能量关系
①甲醇催化脱氢转化为甲醛的反应是________(填“吸热”或“放热”)反应。
②过程Ⅰ与过程Ⅱ的反应热是否相同?____________原因是_______________。
③写出甲醇催化脱氢转化为甲醛的热化学反应方程式_________________________________。
(2)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是________。
A.CH3OH转变成H2的过程一定要吸收能量
B.①反应中,反应物的总能量高于生成物的总能量
C.根据②推知反应:CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
D.反应②的能量变化如图所示
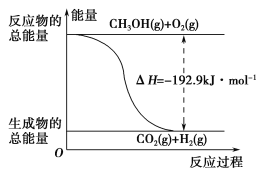
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物w用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下:

已知![]()
请回答下列问题
(1)F的名称是__________⑤的反应类型是__________。
(2)E中的含氧官能团的名称为__________,W的结构简式为__________。
(3)反应②的化学方程式是__________。
(4)D自身还能发生聚合反应,其聚合产物的结构简式为__________。
(5)参照有机物W的上述合成路线,设计以M为起始原料制备F的合成路线(其他试剂任选) __________。
示例:CH3CH2OH![]() CH2=CH2
CH2=CH2![]() BrCH2CH2Br
BrCH2CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能大量共存的是
A.Fe3+、Cu2+、Cl-、NO3—B.H+、Na+、AlO2—、CO32—
C.Ca2+、Fe2+、SO42—、ClO-D.Mg2+、NH4+、OH-、HCO3—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水反应生成一种氯化物和两种氮化物。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

①制备NO发生装置可以选用___________________(填写字母代号),请写出发生反应的离子方程式:___________________。
②欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→ __________________(按气流方向,用小写字母表示)。
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:


①实验室也可用X装置制备NO,X装置的优点为________________________________。
②检验装置气密性并装入药品,打开K2,然后再打开 ____________,通入一段时间气体,其目的为___________________________,然后进行其他操作,当Z有一定量液体生成时,停止实验。
③若无装置Y,则Z中NOCl可能发生反应的化学方程式为________________________。
④若尾气处理装置连接上图烧杯中导管d,则烧杯中可加入 __________溶液。
(3)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmolL-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL。则亚硝酰氯(NOC1)的质量分数为________(用代数式表示)。
[已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲基丙烯酸甲酯是合成有机玻璃的单体,其新的合成方法之如下:CH3-C≡CH+CH3OH+A![]() CH2=C(CH3)COOCH3,下列说法正确的是
CH2=C(CH3)COOCH3,下列说法正确的是
A. 已知该反应的原子利用率为100%,则A为CO2
B. CH2=C(CH3)COOCH3分子中所有碳原子一定共面
C. 该方法的优点是原料无爆炸危险
D. CH3- C![]() CH与丙烯的化学性质相似,可以发生加成、氧化反应
CH与丙烯的化学性质相似,可以发生加成、氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com