
【题目】关于下列各实验装置的叙述中,不正确的是( )
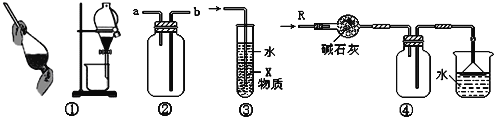
A. 装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
B. 装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
C. 装置①可用于分离C2H5OH和H2O的混合物
D. 装置④可用于干燥、收集NH3,并吸收多余的NH3
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.用铝粉和NaOH溶液反应制取少量H2:Al+2OH-= AlO2-+H2↑
B.过量铁粉与一定量稀硝酸反应:Fe+4H++NO3-=Fe3++NO↑+2H2O
C.澄清石灰水中加入过量NaHCO3溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
D.向苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素单质及其化合物有广泛用途,请回答下列问题:
(1)第三周期元素中,钠原子核外有_______种能量不同的电子;氯原子的最外层电子排布式为______________;由这两种元素组成的化合物的电子式为__________。
(2)下列气体能用浓硫酸干燥的是________。
A.NH3 B.HI C.SO2 D.CO2
(3)请用一个实验事实说明钠与镁的金属性强弱________________________________。
(4)KClO3可用于实验室制O2,若不加催化剂,400 ℃时可分解生成两种盐,化学方程式为:KClO3 ![]() KCl+KClO4 (未配平),则氧化产物与还原产物的物质的量之比为_________。
KCl+KClO4 (未配平),则氧化产物与还原产物的物质的量之比为_________。
(5)已知:
化合物 | MgO | MgCl2 |
类型 | 离子化合物 | 离子化合物 |
熔点/℃ | 2800 | 714 |
工业上电解MgCl2制单质镁,而不电解MgO的原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)装置图1中A的名称是________,B的名称是_______。A中一般要加入碎瓷片,其作用是________________。装置图4中盛溶液的仪器名称是________。
(2)为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是__________(从下列仪器中选出所需仪器,用标号字母填写在空白处);
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
②步骤③的实验选择上述装置图____(填图的序号)。步骤⑤的实验操作名称是_____,选择上述装置图____(填图的序号)。步骤⑥的目的是从含碘苯溶液中分离出单质碘,同时回收苯,该步骤的实验操作名称是_________,选择上述装置图___(填图的序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】80℃时,NO2(g)+SO2(g)![]() SO3(g)+NO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列判断不正确的是( )
SO3(g)+NO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列判断不正确的是( )
起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/mol ·L-1 | 0.10 | 0.20 | 0.20 |
c(SO2)/mol ·L-1 | 0.10 | 0.10 | 0.20 |
A.平衡时,乙中SO2的转化率大于50%
B.当反应平衡时,丙中c(SO2)是甲中的2倍
C.温度升至90℃,上述反应平衡常数为25/16,则正反应为吸热反应
D.其他条件不变,若起始时向容器乙中充入0.10mol ·L-1 NO2和0.20 mol ·L-1 SO2,达到平衡时c(NO)与原平衡不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的数值,下列说法正确的是( )
为阿伏加德罗常数的数值,下列说法正确的是( )
A.100g 46%甘油水溶液中含—OH的数目为1.5NA
B.1.7g由NH3与13CH4组成的混合气体中含质子总数为NA
C.0.1molL-1的Al2(SO4)3溶液中含Al3+的数目小于0.2 NA
D.反应CH4 + 2NO + O2 = CO2 + N2 + 2H2O,每消耗标准状况下22.4L NO,反应中转移的电子数目为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如下图所示,其中A为澄清溶液,C为难溶于水的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。请回答下列问题:
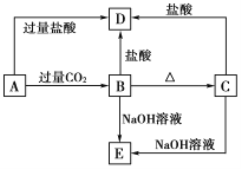
(1)写出化学式:A__________C__________
(2)写出下列反应的离子方程式:
A→B:________________________________。
B→D:________________________________。
C→E:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 4NH3+5O2 = 4NO+6H2O(g),若反应速率分别用 v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是( )
A.v(O2)=![]() v(NH3)B.v(H2O)=
v(NH3)B.v(H2O)= ![]() v(O2)C.v(H2O)=
v(O2)C.v(H2O)=![]() v(NH3)D.v(NO)=
v(NH3)D.v(NO)= ![]() v(O2)
v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定稀硫酸和氢氧化钠溶液反应的中和热(实验装置如下图所示)。
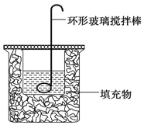
(1)图中尚缺少的一种仪器是__________
(2)烧杯间填满碎纸屑的作用是__________。
(3)写出反应的热化学方程_____________________(中和热为57.3kJ·mol-1)。
(4)该同学每次分别取0.50mol·L-1 50mL NaOH溶液和0.50mol·L-1 30mL硫酸进行实验,通过多次实验测定中和热ΔH=-53.5kJ·mol-1,与57.3kJ·mol-1有偏差,产生偏差的原因不可能是__________(填字母)。
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸溶液的温度
(5)在测定中和热的实验中,下列说法正确的是(____________)
A.使用环形玻璃棒是为了加快反应速率,减小实验误差
B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
C.用0.5mol·L-1 NaOH溶液分别与0.5mol·L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同
D.在测定中和热实验中需要使用的仪器有天平、量筒、烧杯、滴定管、温度计
(6)用相同浓度和体积的氨水代替溶液进行上述实验,测得的中和热的数值会__________;(填“偏大”、“偏小”或“无影响”)。
(7))你认为CH3COOH的中和热与HCl的中和热数值相比,________较大,其原因是______________________________________________________。
(8)若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差t2-t1分别为①2.2 ℃ ②2.4 ℃ ③3.4 ℃,则最终代入计算式的温差均值为________ ℃。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com