
下列说法正确的是
A.镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的
B.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,说明BaCl2溶液显酸性
C.合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动
D.汽车尾气的净化反应2NO+2CO 2CO2+N2 △H<0,则该反应一定能自发进行
2CO2+N2 △H<0,则该反应一定能自发进行
科目:高中化学 来源:2013-2014江苏省无锡市高一下学期期末考试化学试卷(解析版) 题型:填空题
乙酸乙酯可以做白酒勾兑用香料、人造香精。实验室制乙酸乙酯的主要装置如图7所示,主要步骤:①在a试管中按3∶2∶2的体积比配制浓硫酸、乙醇、乙酸的混合物;②按图7连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液中;③小火加热a试管中的混合液;④等b试管中收集到约2 mL产物时停止加热。撤下b试管并用力振荡,然后静置待其中液体分层;⑤分离出乙酸乙酯。(加热装置略)
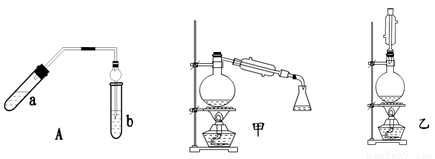
图7 图8 图9
请回答下列问题:
(1)步骤①中,配制混合溶液的正确操作是 。
(2)步骤②中b试管中饱和Na2CO3溶液的主要作用 。(填字母)
a. 降低乙酸乙酯的溶解度
b. 除去实验中挥发出来的硫酸
c. 除去乙酸乙酯中混有的乙酸和乙醇
(3)图7装置中使用球形干燥管除起到冷凝作用外,另一重要作用是 ,步骤⑤中分离乙酸乙酯必须使用的一种玻璃仪器是 。
(4)为充分利用反应物,提高乙酸乙酯产量,甲、乙两位同学分别设计了图8和图9两种装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物)。你认为效果较好的是 。
(5)若实验中用CH3CH218OH的乙醇与乙酸(CH3COOH)作用,此反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:实验题
(14分)碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
(1)合成该物质的步骤如下:
步骤1:配制0.5 mol·L-1MgSO4溶液和0.5 mol·L-1NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL三口烧瓶中,开启搅拌器。温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完后,用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤、洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得碳酸镁晶须产品(MgCO3·nH2O n=1~5)。
回答下列问题:
步骤3中加氨水后的离子方程式 。
(2)测定合成的MgCO3·nH2O中的n值。称量1.000 g碳酸镁晶须,放入如图所示的广口瓶中加入水滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,反应后期将温度升到30 ℃,最后的烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次。


①图中气球的作用是 。
②上述反应后期要升温到30℃,主要目的是 。
③用已知浓度的盐酸滴定烧杯中的溶液时应选用 为指示剂,若盛放盐酸的滴定管在滴定前有气泡未排尽,滴定后无气泡(其他操作均正确),则所测CO2的量会 (填“偏大”“偏小”“无影响”)
④设3次实验测得每1.000 g碳酸镁晶须与稀硫酸反应产生的CO2平均值为a mol,则n值为 (用含a的表达式表示)。
(3)称取100 g上述晶须产品进行热重分析,热重曲线如图。则该条件下合成的晶须中,n= (选填1、2、3、4、5)。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:选择题
在下列溶液中,各组离子一定能够大量共存的是
A.常温下水电离出的c(OH-)=10-13的溶液中:Na+、ClO-、F-、K+
B.能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br-
C.含有大量Al3+的溶液:Na+、Cl-、S2-、OH-
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO 、S2-、SO
、S2-、SO
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高三模拟考试化学试卷(解析版) 题型:实验题
亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
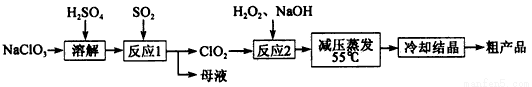
(1)提高“反应l”反应速率的措施有______________(写出一条即可)。
(2)“反应2”的氧化剂是________,该反应的化学方程式为__________。
(3)采取“减压蒸发”而不用“常压蒸发”,原因是__________________。
(4)从 “母液”中可回收的主要物质是__________________________。
(5)“冷却结晶”后经_____________(填操作名称)即可获得粗产品。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高三模拟考试化学试卷(解析版) 题型:选择题
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。
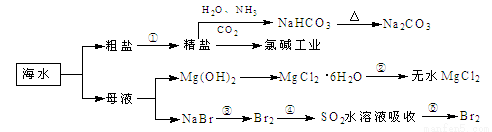
下列有关说法正确的是
A.过程①中除去粗盐中的SO、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B.用澄清的石灰水可鉴别NaHCO3和Na2CO3
C.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2
D.工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:填空题
(14分)甲醇是重要的化工原料,在工业生产上的应用十分广泛。
(1)利用太阳能或生物质能分解水制H2,然后可将H2与CO2转化为甲醇。已知:
光催化制氢:2H2O(l)===2H2(g)+O2(g) ΔH=+571.5 kJ/mol ①
H2与CO2耦合反应:3H2(g)+CO2(g)===CH3OH(l)+H2O(l) ΔH=-137.8 kJ/mol ②
则反应:2H2O(l)+CO2(g) = CH3OH(l)+3/2O2(g)的ΔH= kJ/mol。
你认为该方法需要解决的技术问题有 (填字母)。
a. 开发高效光催化剂
b. 将光催化制取的H2从反应体系中有效分离,并与CO2耦合催化转化
c. 二氧化碳及水资源的来源供应
(2)工业上由甲醇制取甲醛的两种方法如下(有关数据均为在298 K时测定):
反应I:CH3OH(g)=HCHO(g)+H2(g) ΔH1=+92.09kJ/mol,K1=3.92×10-11。
反应II:CH3OH(g)+1/2O2(g)=HCHO(g)+H2O(g) ΔH2=-149.73 kJ/mol,K2=4.35×1029。
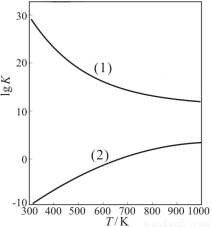
①从原子利用率看,反应 (填“I”或“II”。下同)制甲醛的原子利用率更高。从反应的焓变和平衡常数K值看,反应 制甲醛更有利。
②下图是甲醇制甲醛有关反应的lgK(平衡常数的对数值)随温度T的变化。图中曲线(1)表示的是反应 。
(3)污水中的含氮化合物,通常先用生物膜脱氮工艺进行处理,在硝化细菌的作用下将NH4+氧化为NO3-(2NH4++3O2=2HNO2+2H2O +2H+;2HNO2 +O2=2HNO3)。然后加入甲醇,甲醇和NO3-反应转化为两种无毒气体。
①上述方法中,1 g铵态氮元素转化为硝态氮元素时需氧的质量为 g。
②写出加入甲醇后反应的离子方程式: 。
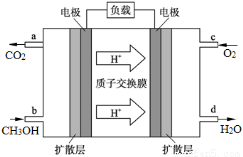
(4)甲醇燃料电池的工作原理如图所示,则该电池负极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.使苯酚显紫色的溶液:NH4+、K+、SCN-、NO3-
B.澄清透明的溶液:Cu2+、Mg2+、SO42-、Cl-
C.0.1 mol·L-1 Na2CO3溶液:NH4+、Fe2+、SO42-、NO3-
D.c(Fe2+)=1.0 mol·L-1溶液:H+、K+、Cl-、MnO4-
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省吴江市高二下学期期中考试化学试卷(解析版) 题型:填空题
(14分)铜单质及其化合物在很多领域有重要的用途,如超细铜粉可应用于导电材料、催化剂等领域中。超细铜粉的某制备方法如下:

(1)[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能从大到小的顺序为: 。
(2) SO42-中硫原子的杂化轨道类型是 :写出一种与SO42-互为等电子体的分子 。
(3)某反应在超细铜粉做催化剂作用下生成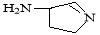 ,则分子中 σ 键与 π 键之比为
,则分子中 σ 键与 π 键之比为
(4)该化合物[Cu(NH3)4]SO4中存在的化学键类型有 。(填字母)
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
(5)NH4CuSO3中的金属阳离子的核外电子排布式为 。
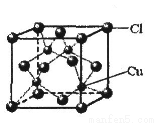
(6)铜的某氯化物的晶胞结构如图所示,该化合物的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com