
| A. | 13C与14C属于同一种元素,它们互为同位素 | |
| B. | 28g乙烯和氮气的混合气体中含有NA个气体分子 | |
| C. | 海轮外壳上镶入锌块,可减缓船体的腐蚀 | |
| D. | 常温下,1mol•L-1的 Na2CO3溶液中阴离子总数大于2NA |
分析 A.同种元素构成的不同种原子互为同位素;
B.乙烯与氮气的摩尔质量相同,均是28g/mol;
C.锌比铁活泼,在两者构成的原电池中,Zn作负极;
D.碳酸钠属于强碱弱酸盐,碳酸根离子水解,且溶液体积未知,不能计算物质的量.
解答 解:A.13C 与14C均是C元素形成的不同种原子,互为同位素,故A正确;
B.由于乙烯和氮气的摩尔质量相同,故两者总共28g,物质的量之和为1mol,含有气体分子数是NA个,故B正确;
C.锌比铁活泼,两者构成的原电池中锌被腐蚀,Fe被保护,故C正确;
D.1mol/L的碳酸钠溶液,不知溶液的条件,无法计算其物质的量,故D错误,故选D.
点评 本题主要考查的是同位素的概念、原电池原理、盐类水解的应用以及物质的量的有关计算,综合性较强,但是难度不大,属于基础题.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子里含有双键的有机物一定是烯烃 | |
| B. | 分子里含有苯环和羟基的化合物一定属于酚类 | |
| C. | 醛类的通式是CnH2nO(n≥1) | |
| D. | 相对分子质量为46的烃的含氧衍生物不一定是乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:N>P>As>Sb>Bi | B. | 酸性:HNO3>H3PO4>H3AsO4>H3SbO4 | ||
| C. | 稳定性:NH3<PH3<AsH3<SbH3 | D. | 稳定性:HCl>H2S>PH3>SiH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
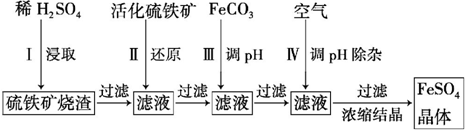
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 称取2.0gNaOH固体 | 先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 |
| B | 制备Fe(OH)3胶体 | 向氯化铁饱和溶液中逐滴加入少量NaOH溶液,加热煮沸至液体变为红褐色 |
| C | 证明碳酸的酸性强于硅酸 | CO2通入Na2SiO3溶液中,析出硅酸胶体 |
| D | 萃取碘水中的碘 | 将碘水倒入分液漏斗,然后再注入酒精,振荡,静置分层后,下层液体从下口放出,上层液体从上口倒出 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过程中可能有:c(Na+)>c(OH-)=c(CH3COO-)>c(H+) | |
| B. | 整个过程中都有:c(OH-)-c(H+)=c(Na+)-c(CH3COO-) | |
| C. | 当滴入10.0 mLNaOH溶液时有:c(CH3COOH)-c(CH3COO-)═2[c(OH-)-c(H+)] | |
| D. | 当滴入10.0 mLNaOH溶液时混合溶液的pH=4.75,则:c(CH3COO-)>c(CH3COOH)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com