
| A. | 向FeBr2溶液中通入等物质的量的Cl2:Cl2+2Br-=2 Cl-+Br2 | |
| B. | 4mol/L NaAlO2溶液和7mol/L盐酸等体积均匀混合:4AlO2-+7H++H2O=3Al(OH)3↓+Al3+ | |
| C. | 向NaAlO2 溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| D. | NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
分析 A.二价铁离子还原性强于溴离子,氯气少量先氧化二价铁离子;
B.偏铝酸钠和盐酸按照物质的量之比4:7反应生成氢氧化铝沉淀、氯化铝和氯化钠;
C.二氧化碳过量反应生成碳酸氢钠和氢氧化铝;
D.NaHSO4和Ba(OH)2按照物质的量之比为2:1反应溶液呈中性.
解答 解:A.向FeBr2溶液中通入等物质的量的Cl2,离子方程式:2Cl2+2Fe2++2Br-=4Cl-+Br2+2Fe3+,故A错误;
B.4mol/L NaAlO2溶液和7mol/L盐酸等体积均匀混合:4AlO2-+7H++H2O=3Al(OH)3↓+Al3+,故B正确;
C.向NaAlO2 溶液中通入过量CO2,离子方程式:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故C错误;
D.NaHSO4溶液中滴入Ba(OH)2溶液至中性,离子方程式:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故D错误;
故选:B.
点评 本题考查了离子方程式的正误判断,为高频考点,把握反应的实质、发生的反应及离子反应的书写反应为解答的关键,注意离子反应遵循客观事实、遵循原子个数守恒规律,题目难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
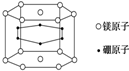
| A. | 22% | B. | 70% | C. | 66.7% | D. | 33.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C5H10O2的酯有9种结构 | B. | 异丁烷的一氯代物有2种 | ||
| C. | 淀粉和纤维素互为同分异构体 | D. | C9H12含苯环的烃有8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给试管中的液体加热时,试管口不准对着别人,但可以对着自己 | |
| B. | 玻璃仪器都可以用于加热 | |
| C. | 在H2还原氧化铜的实验中,应把H2通过预先加热的氧化铜 | |
| D. | 无论给试管中的液体还是固体加热,都必须先预热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2与NaOH溶液反应 | B. | Ba(HCO3)2与澄清石灰水反应 | ||
| C. | Ca(HCO3)2与澄清石灰水反应 | D. | NH4HCO3与澄清石灰水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锗的第一电离能高于碳而电负性低于碳 | |
| B. | 乙烯分子中,只有一个碳碳π键,四个碳氢σ键 | |
| C. | 在铁制品上镀铜时,镀件为阳极,铜盐溶液为电镀液 | |
| D. | 甲醇分子内的O-C-H键角小于甲醛分子内O-C-H键角 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com